Écriture d'une réaction chimique - La réaction bilan de formation de l'eau
Une réaction chimique est une transformation au cours de laquelle au moins une ou plusieurs liaisons chimiques[1] est rompue et/ou formée.
Écriture d'une réaction chimique
Rappelons qu'une réaction chimique résulte d'un ou de plusieurs chocs entre molécules ou atomes et que l'on convient d'écrire une réaction chimique en représentant à gauche d'une flèche les molécules avant le choc et à droite les molécules résultant du choc.
Les espèces chimiques sont représentées par leurs formules chimiques et le nombre de ces espèces correspond au nombre entier le plus faible d'espèces mises en jeu. Ainsi, pour rendre compte de la formation de l'eau à partir des corps simples dihydrogène et dioxygène, on écrira :
\(2.\textrm H_2 + \textrm O_2 \to 2.\textrm H_2\textrm O\)
Cette représentation signifie qu'avant les chocs existent 2 molécules de dihydrogène et une de dioxygène et qu'après on trouve 2 molécules d'eau. Lorsque le nombre d'espèce intervenant dans ce bilan est égal à 1 , ce nombre n'est pas écrit.
L'équation écrite ainsi s'appelle une équation bilan.
La réaction bilan de formation de l'eau
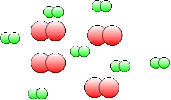
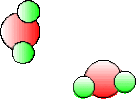
La formation de l'eau à partir de molécules[2] de dihydrogène \(\textrm H_2\) et de dioxygène \(\textrm O_2\) s'effectue à partir de chocs entre ces molécules. Si l'on représente ces molécules de façon schématique , le dihydrogène comme l'association de deux petits atomes[3] d'hydrogène coloriés en vert et le dioxygène comme celle de deux atomes d'oxygène plus gros et arbitrairement représentés en rouge, l'état initial sera représenté comme un ensemble de molécules rouges et vertes et l'état final comme un autre ensemble de molécules \(\textrm H_2\textrm O\) formées de 2 atomes d'hydrogène pour un atome d'oxygène. Pour que toutes les molécules \(\textrm H_2\) et \(\textrm O_2\) aient réagi, il faut qu'il y ait 2 fois plus de molécules d'hydrogène que de molécules d'oxygène.
On peut représenter la transformation avec des molécules schématisées ; dans le tableau ci-dessous on a pris arbitrairement 8 molécules \(\textrm H_2\) : il en résulte que l'on a du représenter 4 molécules \(\textrm O_2\) pour former 8 molécules \(\textrm H_2\textrm O\).
Représentation avec des modèles moléculaires :
Écriture symbolique correspondante :
\(8.\textrm H_2 + 4.\textrm O_2\) | \(\mathbf{\longrightarrow}\) | \(8.\textrm H_2\textrm O\) |
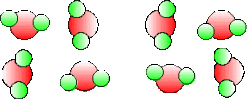
Mais, au lieu de représenter 8 molécules \(\textrm H_2\) et 4 \(\textrm O_2\), on aurait pu plus simplement dessiner 2 molécules \(\textrm H_2\) , une \(\textrm O_2\) et deux \(\textrm H_2\textrm O\). C'est ce qui est fait dans le dessin ci-dessous :
Écriture symbolique correspondante :
\(2.\textrm H_2 + \textrm O_2\) | \(\mathbf{\longrightarrow}\) | \(2.\textrm H_2\textrm O\) |
Cette représentation est la plus simple possible puisqu'il s'agit là de la combinaison la plus élémentaire possible de molécules. C'est pourquoi c'est cette écriture symbolique qui sera utilisée pour représenter la réaction de formation de l'eau.
On écrit parfois les réactions avec des coefficients fractionnaires comme ci-dessous :
\(\textrm H_2 + \frac12.\textrm O_2\) | \(\mathbf{\longrightarrow}\) | \(\textrm H_2\textrm O\) |
Cette écriture , si elle présente l'avantage de faire apparaître le coefficient 1 devant \(\textrm H_2\) et \(\textrm H_2\textrm O\) a l'inconvénient de présenter un bilan avec une demi molécule de dioxygène ce qui laisserait entendre qu'il est possible de couper une molécule en deux. Nous vous conseillons donc d'écrire les réactions chimiques avec des coefficients entiers , ces coefficients étant les plus petits entiers possibles.