Méthodes basées sur la variation de propriétés physiques
Les propriétés physiques d'un système dépendent de sa composition chimique. Il est donc possible de suivre l'évolution de la réaction en mesurant la variation d'une de ses propriétés physiques. Ces mesures peuvent être employées sans nécessiter la séparation préalable des constituants du système. Elles sont généralement rapides, non destructives et automatisables. De ce fait, elles permettent souvent suivre l'évolution de la réaction en continu. Avec les appareils modernes, les mesures se traduisent souvent par une grandeur électrique (tension ou intensité) qui peut être facilement enregistrée par un ordinateur. L'ensemble des données ainsi obtenues sont ensuite analysées à l'aide d'un programme spécifique ou d'un tableur.
Un grand nombre de propriétés physiques variées, peuvent être utilisées pour suivre l'évolution d'une réaction, il suffit que leur valeur dépende de la composition chimique du système.
Pression, Volume, Masse
Mesures de pression
La pression totale d'un système gazeux est reliée au nombre de moles de gaz par une relation d'état, dont la forme la plus simple est l'équation des gaz parfaits :
\(\mathbf{PV = n.RT}\)
Si la réaction s'accompagne d'une variation du nombre de moles de gaz, en opérant dans une enceinte de volume constant et à température constante, la pression totale variera et il sera facile de relier l'avancement de réaction à la pression totale.
Schéma de principe simplifié de l'appareil :
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
On distingue les trois ballons en haut à droite.
On distingue assez mal le manomètre permettant la mesure des pressions.
Le réacteur est contenu dans un système de chauffage.
Le système de pompage à vide se situe en-dessous de la paillasse. Deux systèmes de pompes, avec un circuit primaire et un circuit secondaire pour parfaire le vide.
Exemple : Conduite d'une cinétique par suivie de la variation de la pression du mélange réactionnel
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Relation entre la pression totale et l'avancement de la réaction
Considérons la réaction de décomposition de l'hémipentoxyde d'azote :
\(\mathbf{2.\textrm N_2\textrm O_5 = 4.\textrm{NO}_2 + \textrm O_2}\) que nous noterons pour simplifier \(\mathbf{2.\textrm A = 4.\textrm B + \textrm C}\)
Soient
\(P_0\) la pression initiale et \(n_{\textrm A,0}\) la quantité initiale de \(\textrm A\), les quantités initiales de \(\textrm B\) et \(\textrm C\) étant nulles.
\(P\) la pression totale à l'instant \(t\)
\(V\) le volume et
\(T\) la température.
A l'instant \(t = 0\), on peut écrire \(\mathbf{P_0=\frac{n_{\textrm A,0}}{V}.R.T=C_{\textrm A,0}.R.T}\).
Soit \(\xi\) l'avancement de la réaction à l'instant \(t\) . \(\mathbf{\xi=\frac{n_\textrm A-n_{\textrm A,0}}{-2}=\frac{n_\textrm B}{4}=\frac{n_\textrm C}{1}}\)
Les quantités de \(\textrm A\), \(\textrm B\) et \(\textrm C\) à cet instant t sont respectivement :
\(\displaystyle{\begin{array}{ccc} n_\textrm A=n_{\textrm A,0}-2.\xi \\ n_\textrm B=4.\xi \\ n_\textrm C=\xi \end{array}}\)
Le nombre total de moles est donc \(n=n_\textrm A+n_\textrm B+n_\textrm C=n_{\textrm A,0}+3.\xi\).
Que l'on relie à la pression totale par : \(P=n.\frac{R.T}{V}=(n_{\textrm A,0}+3.\xi).\frac{R.T}{V}\).
D'où \(P-P_0=3.\xi.\frac{R.T}{V}\) et finalement \(\xi=\frac{(P-P_0).V}{3.R.T}\).
Puisqu'on opère à volume constant, il est pratique d'utiliser l'avancement volumique \(\frac{\xi}{V}=\frac{(P-P_0)}{3.R.T}\).
Remarque :
Lorsque la réaction est complète, il ne reste plus du réactif \(\textrm A\) l'avancement de la réaction vaut alors \(\xi=\frac{n_{\textrm A,0}}{2}\)
et le nombre total de moles gazeuse est \(n_\infty=n_{\textrm A,0}+3.\xi=\frac{5}{2}.n_{\textrm A,0}\).
Soient \(P_0\) la pression initiale : \(P_0=n_{\textrm A,0}.\frac{R.T}{V}\).
\(P\) la pression à un instant \(t\) d'avancement \(\xi\) : \(P=(n_{\textrm A,0}+3.\xi).\frac{R.T}{V}\).
\(P_\infty\) la pression lorsque la réaction est complète : \(P_\infty=\frac{5}{2}.n_{\textrm A,0}.\frac{R.T}{V}\).
Il vient immédiatement : \(\frac{P-P_0}{P_\infty-P_0}=\frac{2.\xi}{n_{\textrm A,0}}\).
Notons que \(2.\xi\) est la quantité de \(\textrm A\) tranformée à un instant donné.
Posons \(x = 2.\xi\) cette quantité. Le rapport \(\alpha=\frac{x}{n_{\textrm A,0}}\) est appelé fraction transformée de \(\textrm A\).
On obtient : \(\mathbf{\frac{P-P_0}{P_\infty-P_0}=\frac{x}{n_{\textrm A,0}}=\alpha}\).
Généralisation
Cette relation est applicable à toute grandeur physique \(X\) dont la valeur est reliée aux quantités ou concentrations des espèces présentes dans le milieu par une relation linéaire. Nous la noterons donc comme une relation importante pour ces applications pratiques :
\(\mathbf{\alpha=\frac{X-X_0}{X_\infty-X_0}}\)
Si les réactifs ne sont pas initialement dans des les proportions stoechiométriques, la fraction transformée \(\alpha\) doit être définie pour le réactif minoritaire.
Mesures de volume
En phase gazeuse
Si une réaction en phase condensée produit un constituant gazeux, il sera facile de suivre l'avancement de la réaction en mesurant le volume de gaz produit en fonction du temps.
Exemple :
L'addition d'une solution de soude concentrée à une solution diluée d'eau oxygénée \(\textrm H_2\textrm O_2\) déclenche la formation de \(\textrm O_2\) selon l'équation de réaction
\(\mathbf{\textrm H_2\textrm O_2=\textrm H_2\textrm O+\frac{1}{2}.\textrm O_{2 (\textrm g)}}\)
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Note : vous trouverez une description détaillée de cette réaction, de la manipulation et du traitement des données dans la partie Observer, Approche expérimentale, Décomposition de l'eau oxygénée (2).
Notez que le volume dégagé étant proportionnel à la quantité formée du (ou des) produit(s) gazeux formés, on peut utiliser la relation générale vue ci-dessus en l'appliquant au volume. Le volume initial étant égal à 0 la relation se simplifie en \(\mathbf{\alpha=\frac{V}{V_\infty}}\).
En phase liquide
Si le volume molaire des réactifs et des produits sont suffisamment différents, il peut être possible de suivre l'avancement de la réaction en mesurant les variations de volume du système. Pour cela on emploie un dilatomètre constitué d'un vase de réaction soigneusement thermostaté relié à un une tige très fine, on mesure simplement la hauteur de liquide dans cette tige (comme pour un thermomètre).
Notez que, dans ce cas également et sauf cas particulier, le volume total du système est une fonction affine des quantités de chaque constituant, on peut utiliser la relation générale vue ci-dessus en l'appliquant au volume \(\mathbf{\alpha=\frac{V-V_0}{V_\infty-V_0}}\) ou si on mesure la hauteur de liquide dans le tube du dilatomètre \(\mathbf{\alpha=\frac{h-h_0}{h_\infty-h_0}}\).
Mesures de masse
La masse totale d'un système fermé ne varie pas avec l'avancement des réactions qui peuvent se produire à l'intérieur de ce système, puisque par définition un système fermé est un système qui n' échange pas de matière avec l'extérieur. Lorsqu'une réaction se produit avec un changement de phase par exemple la consommation d'un métal dont les ions passent en solution, la réaction peut parfois être suivie en déterminant la variation de masse d'une partie du système.
Propriétés optiques
La spectrophotométrie
Elle repose sur la mesure de l'intensité de la lumière absorbée par une solution ou un gaz placé dans une cellule.
La loi de Beer-Lamber\( \mathbf{\frac{I}{I_0}=\exp^{-\epsilon.C.l}}\) donne le rapport de l'intensité de la lumière transmise \(I\) à l'intensité de la lumière incidente \(I_0\) en fonction du coefficient d'extinction moléculaire \(\epsilon\) de la substance absorbance à la longueur d'onde considérée, de sa concentration \(C\) et de la longueur \(l\) traversée par la lumière.

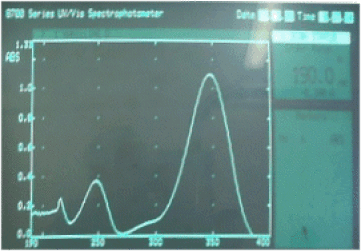
La spectrophotométrie est surtout employée pour les longueurs d'onde correspondant à la lumière visible (entre 400 nm et 700 nm) et à l'UV (en dessous de 400 nm). La réaction peut avoir lieu directement à l'intérieur de la cellule de mesure. Dans ce cas on utilise des cellules à double enveloppe pour pouvoir contrôler la température dans la cellule en maintenant une circulation d'eau thermostatée dans la double enveloppe. Pour les gaz, on utilise des cellules ayant une plus grande longueur. On peut ainsi suivre en continu la variation de l'intensité de la lumière transmise, pour une longueur d'onde fixe. On fixe généralement cette longueur d'onde au maximum d'absorption d'une des substances participant à la réaction. Avec certains appareils, on peut suivre simultanément plusieurs longueur d'onde. Moyennant certaines précautions, on peut en déduire la variation de concentration de la substance absorbante.
La spectrophotométrie est donc une technique de prédilection car les mesures sont simples et rapides. Cependant, pour étudier des réactions extrêmement rapides, il est difficile, voire impossible de faire des mesures à des instants suffisamment rapprochés pour pouvoir suivre avec précision l'évolution de la réaction. On a alors recours à des méthodes particulières telles que les méthodes à flux continu. Dans ce type de méthode, au lieu de préparer le mélange réactionnel dans un réacteur statique à un instant \(t = 0\) et suivre son évolution, on amène les réactifs en continu pour les mélanger.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
La polarimétrie
La polarimétrie repose sur la mesure du pouvoir rotatoire d'une solution placée dans une cellule.
Si une des substance participant à la réaction est chirale, elle dévie le plan de polarisation selon la loi Biot \(\mathbf{\alpha=[\alpha].C.l}\) relation dans laquelle \(\alpha\) est l'angle de rotation du plan de la lumière polarisée qui traverse la solution. Attention à ne pas le confondre avec a la fraction transformée définie plus haut.\( [\alpha]\) est le pouvoir rotatoire spécifique de la substance optiquement active. \(C\) est sa concentration dans la solution et \(l\) est la longueur de la cellule traversée par la lumière polarisée.

Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Propriétés électriques
La conductimétrie
Elle repose sur la mesure de la résistance (ou ce qui revient au même de son inverse, la conductance) du milieu réactionnel.
En solution, il y a variation de la conductance si la réaction entraîne l'apparition ou la disparition d'un ion, ou encore le remplacement d'un ion par un autre. En solution diluée, la conductivité électrique d'une solution est une grandeur additive par rapport aux concentrations des espèces chargées. En négligeant la conductivité du solvant, la conductivité d'un électrolyte est reliée aux concentrations des ions par une relation du type : \(\mathbf{\Lambda=\displaystyle{\sum_i}\lambda_i.C_i}\) relation dans laquelle \(\Lambda\) est la conductivité de la solution. La sommation porte sur tous les ions en solutions.
\(C_i\) est la concentration de l'ion \(i\), \(\lambda_i\) est une grandeur caractéristique de cet ion est appelée conductivité équivalente.
Soient :
\(\Lambda_0\) la conductivité au temps \(t = 0\)
\(\Lambda_t\) la conductivité au temps \(t\)
et \(\Lambda_{0\infty}\) la conductivité lorsque la réaction est complète.
On peut déterminer la fraction transformée \(\alpha\) (rapport entre la quantité transformée et la quantité initiale pour le réactif minoritaire) en appliquant la relation générale et écrire directement \(\mathbf{\alpha=\frac{\Lambda_t-\Lambda_0}{\Lambda_\infty-\Lambda_0}}\).
A partir de \(\alpha\) il est facile de calculer l'avancement de la réaction. En effet nous venons de définir \(\alpha\) par \(\mathbf{\alpha=\frac{x_i}{C_{i,0}}}\) étant le réactif minoritaire et \(C_{i,0}\) sa concentration initiale. Par définition, l'avancement de la réaction s'écrit \(\mathbf{\xi=\frac{x_i}{\nu_i}}\), d'où \(\mathbf{\xi=\frac{\alpha.C_{i,0}}{\nu_i}}\): .
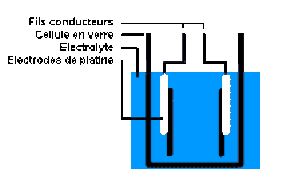
La mesure de la résistance de la solution est simple.
Elle se fait dans une cellule de mesure qui comporte deux plaques métalliques (généralement rectangulaires) permettant d'isoler une petite quantité de solution et d'un appareil de mesure électrique qui donne directement la résistance (ou son inverse).

Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Note : vous trouverez une description détaillée de cette réaction, de la manipulation et du traitement des données dans la partie Observer, Approche expérimentale, Hydrolyse de l'acétate d'éthyle, étude par conductimétrie.
La potentiométrie
Elle repose sur la mesure du potentiel d'équilibre d'une électrode, siège d'une réaction électrochimique, placée dans la solution.
Il existe de nombreuses électrodes dont le potentiel est directement relié au logarithme de l'activité (assimilable en solution diluée à la concentration) d'un ion. Nous n'en présenterons ici que les plus importantes.
Les électrodes dites du premier type sont constituées d'un couple métal / ion métallique et l'électrode à hydrogène, (voir module d'électrochimie), leur potentiel d'équilibre obéit à l'équation de Nenrst : \(\mathbf{E=E°+\frac{R.T}{n.\textrm F}.\ln(\textrm M^{n+})}\) relation dans laquelle \((\textrm{Mn}^+)\) est l'activité (assimilable à la concentration en première approximation) de l'ion \(\textrm{Mn}^+\), \(E_0\) est le potentiel de référence du couple oxydo / réducteur de la réaction qui a lieu sur l'électrode. \(\textrm F\) est la constante de Faraday.
L'électrode dite "de verre" permet la mesure du \(\textrm{pH}\) donc de l'activité des ions \(\textrm H_3\textrm O^+\) en solution.
L'électrode de verre, et l'électrode de référence au calomel sont souvent réunies dans une seule sonde appelée électrode combinée.
L'électrode de verre est constituée d'un bulbe de verre, à paroi très mince contenant un électrolyte (\(\textrm{pH = 7,00}\)) dans lequel plonge un fil d'argent recouvert de \(\textrm{AgCl}\).
D'autres électrodes, telles que l'électrode \(\textrm{Ag / AgCl}\), ou des électrodes dites spécifiques permettent aussi de déterminer la concentration d'une espèce présente dans le milieu par une simple mesure de différence de potentiel par rapport à une référence.
En pratique, on mesure la différence de potentiel \(DV\) d'une pile constituée de l'électrode de mesure et d'une électrode de référence dont le potentiel \(E_\textrm{ref}\) est connu.
\(\mathbf{DV = E - E_\textrm{ref}}\). Comme électrode de référence, on utilise souvent l'électrode au calomel saturé.
Le calomel est le nom donné au chlorure mercureux \(\textrm{HgCl}_2\) qui est un sel pratiquement insoluble.
L'électrode au calomel est constituée d'une petite quantité de mercure (jouant le rôle d'électrode) au contact avec le calomel.
Le contact avec la solution est assuré par une solution de \(\textrm{KCl}\) saturé.
La réaction d'oxydo réduction est la suivante :
\(\textrm{HgCl}_{2 (\textrm s)} + 2.\textrm e^- = 2. \textrm{Hg}_{ (\textrm l)} + 2. \textrm{Cl}^-\)
Son potentiel de référence à 25°C est \(E° = \textrm{0,2445 V}\).
Autres propriétés
Nous n'avons évidemment pas présenté toutes les méthodes expérimentales utilisées pour suivre l'évolution cinétique des réactions.
Un grand nombre d'autres méthodes peuvent être employées : mesure de viscosité, de constante diélectrique, d'indice de réfraction, mesure de la quantité de chaleur dégagée par la réaction (calorimétrie et microcalorimétrie), spectroscopie infra rouge, de RMN, spectrométrie de masse etc...
Les chercheurs s'intéressent de plus en plus l'étude des réactions dans des conditions de plus en plus complexes :
Réactions extrêmement rapides (le prix Nobel de chimie 1999 vient d'ailleurs de récompenser le Professeur Ahmed H. Zewail pour l'étude de réactions à l'échelle de la pfento seconde).
L'Académie Royale des Sciences de Suède a attribué le Prix Nobel de Chimie de l'année 1999 au Professeur Ahmed H. Zewail, California Institute of Technology, Pasadena, États-Unis.

Extrait du communiqué de presse de l'Académie Royale des Sciences de Suède :
"Ahmed H.Zewail a exploité une technique qui peut être décrite comme l'appareil photo le plus rapide au monde. La technique consiste à émettre des éclairs laser si brefs que le chercheur peut suivre les processus réactionnels à l'échelle de durée où ils ont réellement lieu, notamment de l'ordre des femtosecondes (fs), Une femtoseconde est égale à 10-15 secondes, soit à 0,000000000000001 seconde. Cette unité est aussi petite par rapport à la seconde qu'une seconde par rapport à 32 millions d'années. Cette branche de la chimie physicaliste a été baptisée femtochimie. La femtochimie permet de comprendre pourquoi certaines réactions chimiques ont lieu mais pas d'autres. Elle nous aide aussi à comprendre pourquoi la vitesse des réactions et leurs effets sont liés à la température. Grâce à la spectroscopie ultrarapide, des chercheurs du monde entier peuvent étudier les processus dans des gaz, des liquides, des solides, ainsi que sur des surfaces et dans des polymères. Les applications s'étendent du fonctionnement des catalyseurs, en passant par la construction des composants électroniques moléculaires, jusqu'aux mécanismes les plus fins des processus de la vie et au développement des produits pharmaceutiques de demain."
Réactions hétérogènes notamment à la surface des solides.
Réactions dans les conditions extrêmes, très hautes températures et pressions, réactions sous radiation etc..
Réactions dans les systèmes complexes, biologiques, environnement etc..

