Rappel sur la formation des orbitales moléculaires
Une orbitale moléculaire est une combinaison linéaire d'orbitales atomiques. Pour pouvoir être formée, deux conditions sur les orbitales atomiques de départ doivent être réunies :
avoir des énergies proches,
avoir les mêmes symétries.
Il existe deux grands types de liaisons, définies suivant la symétrie du recouvrement entre orbitales atomiques de départ : les liaisons \(\sigma\) et \(\pi\).
Les orbitales σ sont formées par recouvrement axial d'orbitales atomiques.
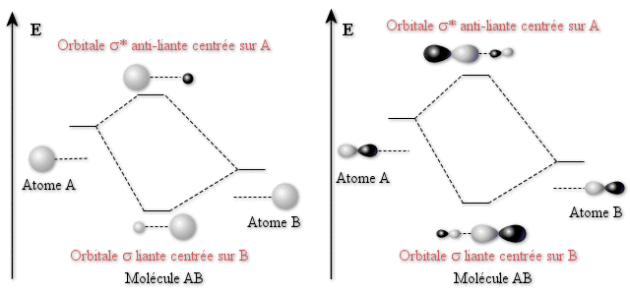
L'exemple le plus simple en est donné par le recouvrement de deux orbitales \(1\textrm s\) dans la formation des orbitales \(\sigma\) liantes et \(\sigma^*\) anti-liantes de la molécule de dihydrogène \(\textrm H_2\). Des orbitales \(\sigma\) peuvent aussi être formées à partir d'orbitales de type \(\textrm p\) si ces dernières sont dirigées le long de l'axe reliant les deux atomes. Ces exemples sont illustrés sur la figure ci-dessous.
Dans le cas ci-dessus, on a pris en considération une molécule dissymétrique \(\textrm{AB}\), l'énergie des orbitales de \(\textrm B\) étant inférieure à celles de \(\textrm A\). L'orbitale liante \(\sigma\) , la plus basse en énergie est principalement centrée sur \(\textrm B\). L'orbitale anti-liante \(\sigma^*\) , la plus basse en énergie est principalement centrée sur \(\textrm A\).
Les orbitales π sont formées par recouvrement de part et d'autre de l'axe d'orbitales atomiques.
Un exemple en est donné par le recouvrement de deux orbitales \(\textrm p\) dans la formation des orbitales \(\pi\). liantes et \(\pi^*\) anti-liantes. Dans la figure ci-dessous, la même molécule \(\textrm{AB}\) qui est précédemment étudiée, les énergies des orbitales de \(\textrm B\) sont inférieures à celles de \(\textrm A\). Là encore, l'orbitale liante \(\pi\) est principalement centrée sur \(\textrm B\), l'orbitale anti-liante \(\pi^*\)sur \(\textrm A\).