Liaison π dans les complexes , exemple d'un ligand π–accepteur : CO
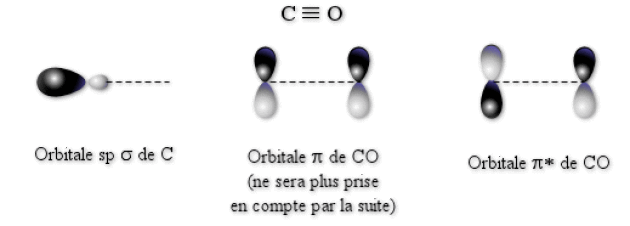
Le dernier cas que nous allons étudier est celui du ligand monoxyde de carbone \(\textrm{CO}\). Sa formule de Lewis est \(\mid\textrm C\equiv\textrm O\mid\). Ce ligand se lie au métal du complexe par l'atome de carbone. Chaque ligand \(\textrm{CO}\) va fournir un doublet non‑liant de type \(\textrm{sp}\) par l'intermédiaire de l'atome de carbone. Ce doublet va être à l'origine de liaisons \(\sigma\) dans le complexe. Comme les ligands précédents, \(\textrm{CO}\) est un ligand \(\sigma\)-donneur. D'autre part, \(\textrm{CO}\) possède aussi des orbitales \(\pi\) liantes pleines. On pourrait imaginer que ce ligand ait des propriétés similaires à celles de \(\textrm{Cl}^-\), et présente donc un champ de ligand faible. En fait, c'est le contraire qui est observé expérimentalement, \(\textrm{CO}\) étant un ligand à champ fort.
Pour expliquer ce phénomène, il faut remarquer que non seulement \(\textrm{CO}\) possède des orbitales \(\pi\) doublement occupées, mais il possède aussi des orbitales \(\pi^*\) vides hautes en énergies. Ces orbitales anti-liantes de \(\textrm{CO}\) vont avoir une énergie supérieure à celles des orbitales \(\textrm d\) du métal. Les propriétés de \(\textrm{CO}\) étant liées à la présence de ces orbitales, nous ne tiendrons compte par la suite que de celles-ci et des orbitales \(\sigma\) (\(\textrm{sp}\) du carbone). L'ordre des énergies des différentes orbitales à prendre en compte est donc :
\(\textrm E(\sigma_\textrm L) < \textrm E(\textrm d_\textrm M) < \textrm E(\pi_\textrm L^*)\)
La forme des différentes orbitales de \(\textrm{CO}\) est représentée sur la figure ci-dessous.
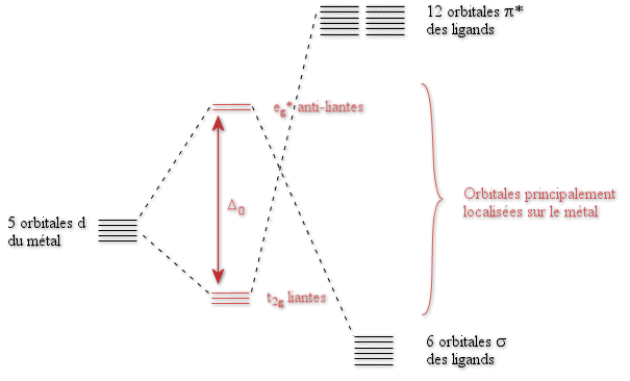
Nous allons donc pouvoir construire le diagramme d'orbitales moléculaires d'un complexe octaédrique de \(\textrm{CO}\). Nous ne prendrons en compte que les orbitales \(\textrm d\) du métal ainsi que les orbitales \(\sigma\) et \(\pi^*\) de \(\textrm{CO}\).
La différence fondamentale avec le cas de \(\textrm{Cl}^-\) provient du fait que les orbitales \(\textrm t_{2\textrm g}\) du métal interagissent avec des orbitales des ligands plus hautes en énergie. Elles vont donc être stabilisées. Les orbitales \(\textrm t_{2\textrm g}\) du métal sont maintenant liantes. La valeur de \(\Delta_0\) va donc être plus élevée que dans tous les cas précédents. La position de \(\textrm{CO}\) dans la série spectrochimique s'en trouve ainsi justifiée.