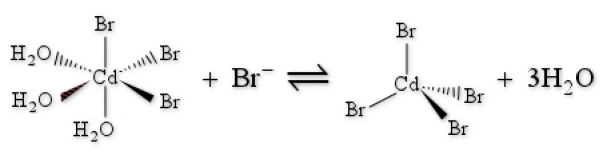Effet statistique
On observe généralement que .
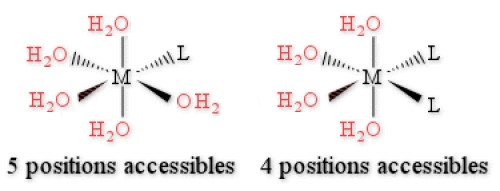
Cette tendance peut s'expliquer facilement en observant que plus un complexe est substitué, plus le nombre de positions labiles accessibles pour une nouvelle substitution diminue.
Exemple :
[\textrm M(\textrm{OH}_2)_5 \textrm L]^{\textrm n+} présente 5 positions susceptibles d'être substituées,
[\textrm M(\textrm{OH}_2)_4 \textrm L_2]^{\textrm n+} n'en présente plus que 4.
Cet effet est un effet statistique et donc entropique (figure ci-dessous).
Rappelons que les effets enthalpiques sont liés à un changement d'énergie du système. Dans les systèmes chimiques, il s'agit en général de la rupture ou de la formation de liaisons qui sont à l'origine de tels changements d'énergie.
Les effets entropiques sont eux liés à des variations du degré de liberté des molécules ou au désordre du système. Plus un système est désordonné, plus son entropie est élevée.
Un écart important à cette règle indique en général un changement important de la structure géométrique et/ou électronique du métal central. Ainsi les constantes de formations successives menant à la formation de [\textrm{CdBr}_4]^{2-} présentent elles une anomalie avec \textrm K_4 > \textrm K_3.
Dans ce cas, le cadmium passe d'une géométrie octaédrique à une géométrie tétraédrique lors de la quatrième substitution par un ion \textrm{Br}^-.
[\textrm{CdBr}_3 (\textrm{OH}_2)_3]^-_\textrm{Octaédrique} + \textrm{Br}^- \Leftrightarrow [\textrm{CdBr}_4]^{2-}_\textrm{tétraédrique} + 3\textrm H_2\textrm O