Rayon atomique
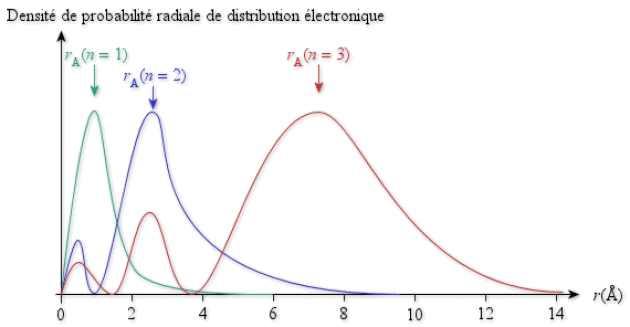
Notion assez floue, le rayon atomique \(r_A\) peut-être défini comme correspondant à la distance du noyau à laquelle la probabilité de présence des électrons de valence est maximale. Il est donc fortement dépendant de la valeur du nombre quantique principal \(n\) (voir figure ci-dessous) et croît avec elle. Ceci est d'ailleurs fort bien prévu par le modèle planétaire de Bohr.
Densité de probabilité électronique radiale pour les orbitales 1s, 2s et 3s, permettant de définir les rayons atomiques associés.
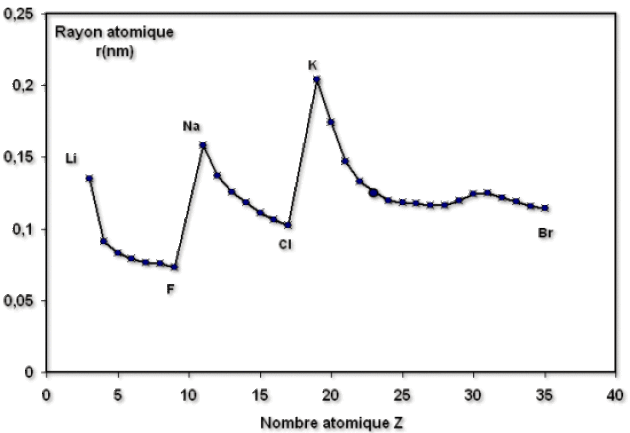
Il en résulte que le rayon \(r_A\) augmente dans une colonne avec \(Z\) (donc \(n\)). Par contre, il diminue dans une même période (\(n\) est constant mais \(Z^*\) augmente), car la force d'attraction exercée par le noyau sur les électrons de valence augmente, ainsi que le montre la figure ci-dessous.
Lorsque l'atome est lié à un autre atome, la disposition du nuage électronique est fortement modifiée par la liaison. Suivant la nature de celle-ci, on définit un rayon covalent, ionique ou métallique, plus à même d'expliquer ou de prévoir l'évolution des distances interatomiques et l'énergie de liaison.