Introduction
Du fait de la valeur élevée de \(EI_i\), les éléments \(p\) constituant les colonnes 14 à 17 possèdent une électronégativité importante qui varie de 3,98 pour le fluor (qui est l'élément le plus électronégatif) à près de 2. Presque tous les non-métaux sont donc des éléments \(p\) (et réciproquement).
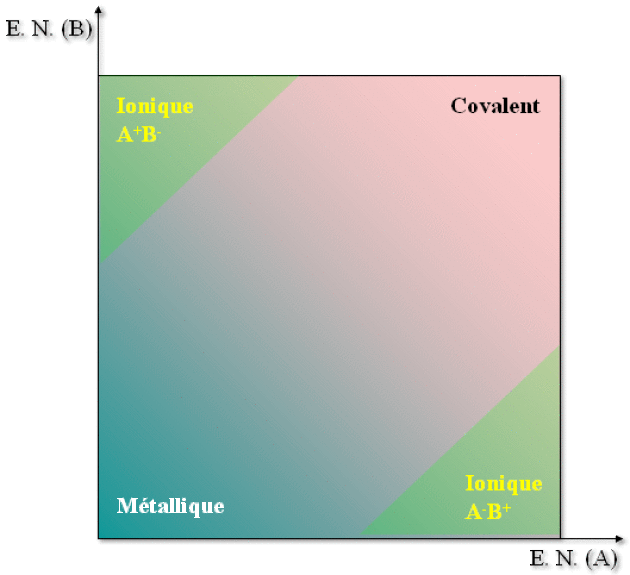
En effet, on se rappelle que la liaison métallique, basée sur la délocalisation des électrons, ne peut être dominante que si les éléments ont une faible électronégativité, c'est-à-dire une faible tendance à localiser les électrons dans les liaisons. Au contraire, la liaison covalente étant basée sur la localisation des électrons entre les atomes, celle-ci est prédominante entre atomes fortement électronégatifs. Enfin, la liaison ionique peut être présente dans des composés d'éléments \(p\) car elle est obtenue pour une forte différence d'électronégativité.
La figure ci-dessous résume la relation entre électronégativités et type de liaison pour un composé \(\textrm{AB}\).
L'électronégativité diminuant lorsque \(Z\) augmente, les éléments les plus lourds et faiblement électronégatifs présentent un certain caractère métallique. D'ailleurs \(\textrm{Sn}\), \(\textrm{Pb}\), et \(\textrm{Bi}\) sont classés comme étant des métaux. Entre métaux et non-métaux, on trouve les semiconducteurs, qui ont des propriétés intermédiaires.