Application : l'eau de Javel
Les deux composants principaux de l'eau de javel sont les ions hypochlorite et chlorure. Elle est fabriquée selon la réaction :
\(\textrm{Cl}_2+2.\textrm{OH}^-\to\textrm{Cl}^-+\textrm{ClO}^-+\textrm H_2\textrm O\)
Complément : Dismutation du dichlore
En étudiant le diagramme de Pourbaix, on a vu que dès que le milieu n'est plus très acide, \(\textrm{Cl}_2\) se dismute en \(\textrm{Cl}^-\) et \(\textrm{HClO}\) pour les \(\textrm{pH}\) inférieurs à 7,5 et en \(\textrm{Cl}^-\) et \(\textrm{ClO}^-\) pour les \(\textrm{pH}\) supérieurs à 7,5.
Ceci se voit également très bien sur le diagramme de Frost à \(\textrm{pH} = 14\).

Industriellement on la fabrique lors de l'électrolyse de \(\textrm{NaCl}\), puisque \(\textrm{Cl}_2\) et \(\textrm{OH}^-\) sont des produits de ce procédé
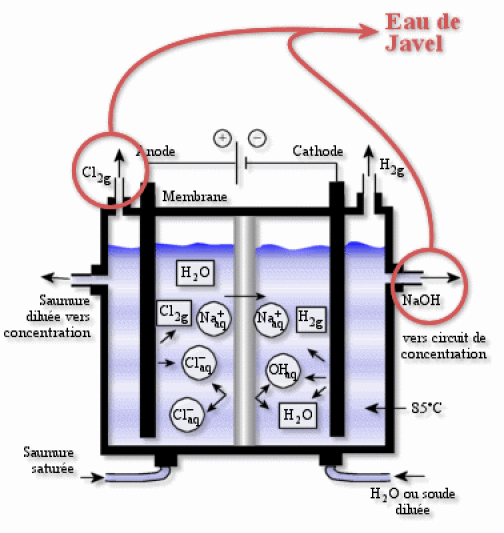
Les propriétés oxydantes de l'eau de Javel, qui sont à l'origine de son action désinfectante, sont dues principalement aux ions hypochlorite \(\textrm{ClO}^-\). C'est un oxydant fort car le chlore est au degré d'oxydation +I. Le potentiel standard apparent à \(\textrm{pH}=14\) est de \(0\textrm,89 \textrm V\), ce qui est appréciable dans la mesure où la cinétique de la demi-réaction est rapide dans bien des cas.
Stabilité dans le temps
L'ion hypochlorite, comme nous l'avons vu au cours de l'étude du diagramme de Pourbaix, est un oxydant :
\(\textrm{ClO}^-+\textrm H_2\textrm O+2.\textrm e^-\to\textrm{Cl}^-+2.\textrm{OH}^-\)
En combinant ce demi-couple avec celui de l'eau réducteur :
\(2.\textrm{OH}^-\to\frac{1}{2}.\textrm O_2\textrm{(g)}+2.\textrm e^-+\textrm H_2\textrm O\)
on obtient le bilan suivant :
\(\textrm{ClO}^-\to\textrm{Cl}^-+\frac{1}{2}.\textrm O_2 \textrm{(g)}\)
Il s'agit en fait de la décomposition de \(\textrm{ClO}^-\), qui est catalysée par l'eau ! Cette réaction est lente, néanmoins elle limite la durée d'utilisation de l'eau de Javel car la concentration en \(\textrm{ClO}^-\) diminue de façon conséquente au cours du temps. Ainsi la durée de conservation de l'eau de Javel diluée est de 1 an. Cette décomposition est accélérée par la lumière, d'où l'utilisation d'un emballage opaque pour la stocker.
Réaction avec un acide
Comme on l'a vu au niveau du chapitre « stabilité des espèces » il y a médiamutation en milieu acide de \(\textrm{Cl}_2\) à partir de la réaction :
\(\textrm{Cl}^-+\textrm{HClO}+\textrm H_3\textrm O^+\to\textrm{Cl}_2+2.\textrm H_2\textrm O\)
Donc l'utilisation de produits acides (détartrant par exemple) avec de l'eau de Javel est à éviter, car elle entraîne le dégagement de dichlore qui est un gaz toxique.
Cette réaction de l'eau de Javel avec un acide est utilisée en laboratoire pour produire \(\textrm{Cl}_2\).