Forme des molécules
On confond souvent figure de répulsion et géométrie de la molécule. La figure de répulsion associée à un atome dans une molécule est déterminée par le nombre total de paires libres et de liaisons, alors que la forme de la molécule résulte de l'arrangement des liaisons uniquement. Dans le cas où la molécule ne met en jeu que des paires liantes, la géométrie de la molécule est alors confondue avec la figure de répulsion. Par contre, s'il y a un ou plusieurs paires non liantes, la géométrie de la molécule, c'est-à-dire l'orientation relative des liaisons atomiques, ne correspond plus à la figure de répulsion.
Exemple :
Dans les exemples suivants, on a représenté les molécules suivant le mode "boules et batons". La figure de répulsion est visualisée par des liens similaires aux figures précédentes ainsi que les paires libres.
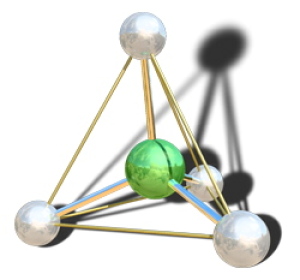
Dans la molécule de méthane \(\textrm{CH}_4\), le carbone central (en vert) possède 4 paires liantes ; il forme quatre liaisons simples avec les hydrogènes (en blanc). Le type VSEPR est \(\textrm{AX}_4\). La figure de répulsion associée (schématisée en jaune) est donc tétraédrique. La géométrie de la molécule est inscrite dans un tétraèdre, comme la figure de répulsion.
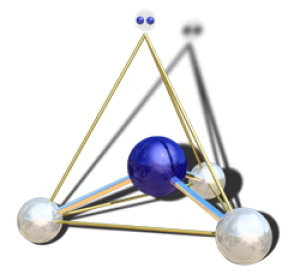
Dans la molécule d'ammoniac \(\textrm{NH}_3\), l'azote (en bleu) possède 4 paires électroniques : 3 paires liantes et une paire non liante. Le type VSEPR est \(\textrm{AX}_3\textrm E\). La figure de répulsion est aussi un tétraèdre, mais la forme de la molécule n'est déterminée que par les quatre atomes. C'est une pyramide à base triangulaire.
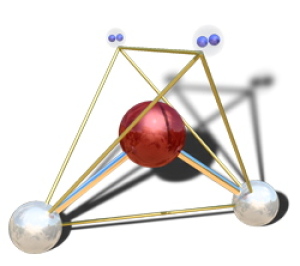
Dans la molécule d'eau \(\textrm H_2\textrm O\), l'oxygène central (en rouge) possède 4 paires liantes et deux paires libres. Le type VSEPR est \(\textrm{AX}_2\textrm E_2\) et la figure de répulsion associée est donc aussi tétraédrique. En revanche la géométrie de la molécule, définie par les trois atomes est coudée, ou "en V".