L'acide cyanhydrique
Dans la molécule \(\textrm{HCN}\), le carbone est de type \(\textrm{AX}_2\) ; il est hybridé \(\textrm{sp}\). L'azote est de type \(\textrm{AXE}\) ; il est aussi hybridé \(\textrm{sp}\). Ces atomes forment une liaison axiale par recouvrement d'hybrides colinéaires. La paire libre de l'azote se positionne le plus loin possible de la liaison, sur l'autre hybride. Les orbitales \(2\textrm p\) de l'azote accommodent chacune un électron et peuvent former deux liaisons latérales \(\pi\) avec les orbitales \(2\textrm p\) du carbone. Un électron du carbone occupe la dernière hybride et forme une liaison axiale \(\sigma\) avec l'hydrogène.

Schéma d'hybridation dans HCN
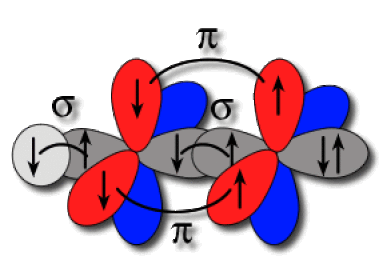
Liaisons axiales et latérales
L'établissement de la triple liaison impose la colinéarité des liaisons \(\sigma\).
L'hybridation \(\textrm{sp}\) est typique des environnements linéaires.
On donne ci-contre le schéma de cases quantiques hybridées. Les hybrides forment les liaisons \(\sigma\) et les orbitales \(2\textrm p\) les liaisons \(\pi\).
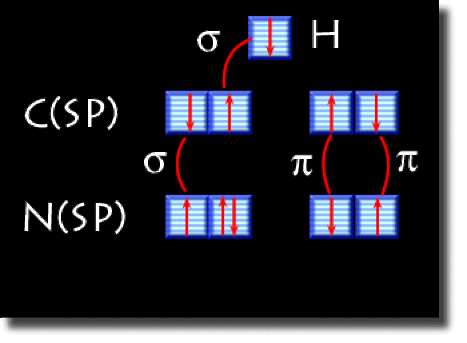
Schéma de cases quantiques