Expériences de Hill
La réaction globale de la photosynthèse montre qu'il s'agit d'une réaction d'oxydo-réduction. Est-il possible de dissocier l'incorporation du \(CO_{2}\) (réduction) de la formation de \(O_{2}\) (oxydation) ?
Hill réalise son expérience sur une suspension de chloroplastes éclairée et utilise, en absence de \(CO_{2}\), un réducteur artificiel : le ferricyanure de potassium.
Cette expérience peut être réalisée en TP. On utilisera ici le DCPIP (dichloro-phéno-indo-phénol) qui a la propriété d'être bleu à l'état oxydé et incolore à l'état réduit. Le matériel biologique est une suspension de chloroplastes préparée à partir, par exemple, de feuilles d'épinard.
1. Réduction d'un accepteur d'électrons à la lumière
La solution de pigments bruts a été préparée par extraction globale d'une feuille de plante supérieure, à l'aide d'éthanol ou d'acétone.
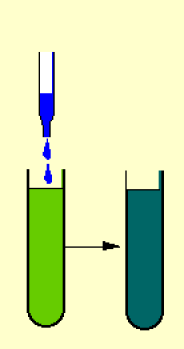
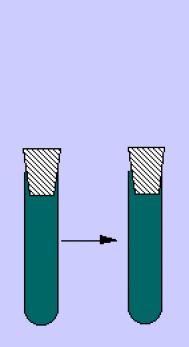
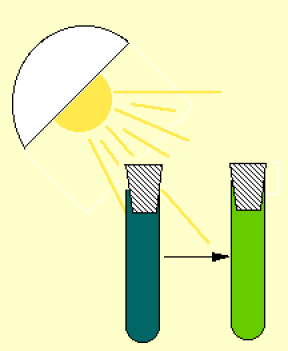
A la lumière (et en absence de \(CO_{2}\)), la suspension de chloroplastes est capable de réduire un accepteur d'hydrogène et d'électrons.
2. Production de dioxygène à la lumière
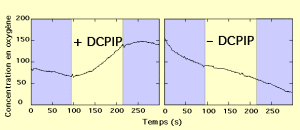
On peut compléter cette expérience par polarographie. A l'aide d'un oxygraphe, lors d'une séquence obscurité-lumière-obscurité, on enregistre les variations de concentration en dioxygène en présence, ou non, de DCPIP.
Cette expérience est réalisée en absence de toute source de carbone.
En mesurant le dioxygène produit à l'aide de l'électrode à oxygène. La suspension de chloroplastes est soumise à une alternance obscurité/lumière en l'absence de \(CO_{2}\).
Cette production n'est réalisée qu'en présence d'un accepteur d'hydrogène.
La photosynthèse ne peut pas fonctionner (puisqu'il n'y a pas de source de carbone) ; et pourtant, on observe une production de dioxygène. Remarquons que, dans le même temps, le substrat oxydé est passé à l'état réduit.
Cette expérience montre qu'en l'absence de \(CO_{2}\), l'oxydation de l'eau peut se réaliser s'il existe un accepteur d'\(H_{2}\) (\(H^{+}\) + \(e^{-}\)).