Ordre 2 par rapport à un seul réactif
Loi de vitesse
Par définition, la vitesse de la réaction s'écrit :
\(\mathbf{\textrm v=\frac{1}{\nu_\textrm A}\times\frac{\textrm dC_\textrm A}{\textrm dt}}\)
Pour une réaction du type \(2.\textrm A = \textrm P\), \(\nu_\textrm A = - 2\).
La loi de vitesse étant d'ordre 2 par rapport à A on peut écrire :
\(\mathbf{\textrm v=\frac{1}{\nu_\textrm A}\times\frac{\textrm dC_\textrm A}{\textrm dt}=k.C_\textrm A^2}\)
qui s'intègre en
\(\mathbf{\frac{1}{C_\textrm A}-\frac{1}{C_{\textrm A0}}=-\nu_\textrm a.k.t}\)
avec \(\nu_\textrm A = - 2\) d'où
\(\mathbf{\frac{1}{C_\textrm A}-\frac{1}{C_{\textrm A0}}=2.k.t} (k \textrm{en L.mol}^{-1}\textrm{.s}^{-1})\)
De l'expression précédente, on tire facilement la relation qui permet de calculer la concentration de \(\textrm A\) à un instant \(t\) :
\(\mathbf{C_\textrm A=\frac{C_{\textrm A0}}{1+2.k.C_{\textrm A0}.t}}\)
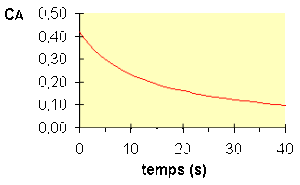
La variation de \(C_\textrm A\) au cours du temps est représentée sur la figure ci-dessous :
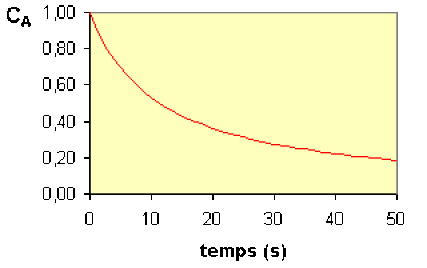
Cliquez ici[1] pour une comparaison des variations \(C_\textrm A\) pour des réactions d'ordre 1 et d'ordre 2.
Remarque : Ecriture de l'équation bilan
Rappelons que les coefficients stœchiométriques de l'équation bilan définissent dans quelle proportion les réactifs réagissent et les produits se forment.
Ils peuvent donc être multipliés ou divisés par un facteur constant.
Dans ce qui précède, nous avons écrit la réaction \(2.\textrm A = \textrm P\)
Le coefficient stœchiométrique \(\nu_\textrm A\) est égal à - 2.
Nous aurions tout aussi bien pu écrire : \(\textrm A = \frac{1}{2} \textrm P\) avec \(\nu_\textrm A = - 1\).
Evidemment, la vitesse de la réaction définie par \(\mathbf{\textrm v'=-\frac{\textrm dC_\textrm A}{\textrm dt}}\) serait égale au double de la vitesse telle que nous l'avions définie par \(\mathbf{\textrm v=-\frac{1}{2}\times\frac{\textrm dC_\textrm A}{\textrm dt}}\)
En posant \(\mathbf{\textrm v'=-\frac{\textrm dC_\textrm A}{\textrm dt}=k'.C_{\textrm A,0}}\)
on trouve la loi de vitesse intégrée \(\mathbf{\frac{1}{C_\textrm A}-\frac{1}{C_{\textrm A,0}}=k'.t}\)
qui est bien identique à l'équation \(\mathbf{\frac{1}{C_\textrm A}-\frac{1}{C_{\textrm A,0}}=2.k.t}\) avec \(\mathbf{\textrm v=k.C_\textrm A^2}\).
Ceci montre que la définition de la vitesse, donc la valeur des coefficients de vitesse dépend de l'écriture de l'équation bilan.
Complément : Autre formes de la loi de vitesse
Il est parfois utile d'introduire comme variable \(x\) la concentration transformée.
On pose \(a = C_{\textrm A,0}\) d'où \(C_\textrm A = a - x\)
\(\mathbf{-\frac{\textrm dC_\textrm A}{\textrm dt}=\frac{\textrm dx}{\textrm dt}}\) d'où \(\mathbf{v=-\frac{1}{2}\times\frac{\textrm dC_\textrm A}{\textrm dt}=\frac{\textrm dx}{\textrm dt}=k.(a-x)^2}\)
La loi de vitesse intégrée s'écrit alors :
\(\mathbf{\frac{1}{a-x}-\frac{1}{a}=2.k.t}\)
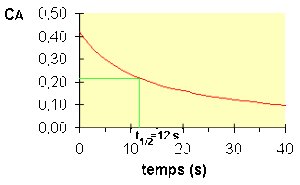
Temps de demi-vie
Le temps de demi-vie se déduit de la loi de vitesse intégrée en posant \(\mathbf{C_\textrm A=\frac{C_{\textrm A0}}{2}}\) d'où :
\(\mathbf{t_{\frac12}=\frac{1}{2.k.C_{\textrm A0}}}\)
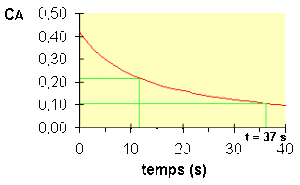
Pour une réaction d'ordre 2, le temps de demi-vie est donc inversement proportionnel à la concentration. Voir figure ci-dessous :
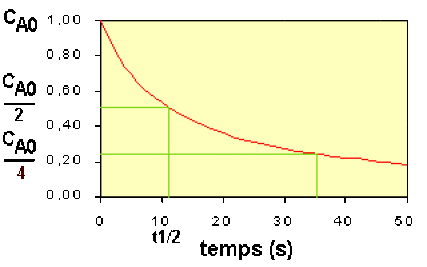
Le temps de demi-vie d'une réaction du second ordre est inversement proportionnel à la concentration du réactif.
Cette observation n'est pas sans conséquences en ce qui concerne la dégradation de substances toxiques dans l'environnement.
Les substances qui se décomposent suivant une réaction du second ordre mettront beaucoup plus de temps pour s'éliminer que celles qui subissent des dégradations du premier ordre.
Vérification de l'ordre 2
Position du problème :
On étudie une réaction et on désire s'assurer qu'elle suit une loi du second ordre. Si c'est bien le cas, on désire généralement déterminer la valeur du coefficient de vitesse. Dans ce qui suit, on examinera seulement le cas d'un ordre deux par rapport à un seul réactif. Le cas des réactions d'ordre global deux faisant intervenir deux réactifs avec un ordre partiel égal à un pour chacun d'eux est traité dans le paragraphe suivant.
On peut effectuer cette vérification à partir :
des valeurs des temps de demi-vie,
des valeurs des vitesses correspondantes à différentes concentrations,
des valeurs de concentrations mesurées au cours du temps.
Explication :
Vérification à partir des valeurs des temps de demi-vie
Le temps de demi-vie d'une réaction du second ordre est inversement proportionnel à la concentration du réactif.
\(\mathbf{t_{\frac12}=\frac{1}{2.k.C_{\textrm A0}}}\)
On peut vérifier qu'une réaction est d'ordre deux en s'assurant que, pour plusieurs concentrations \(C_{\textrm A0}\) , le produit \(t_{\frac12}\times C_{\textrm A0}\) est constant.
Remarque :
Cette vérification peut porter sur plusieurs expériences effectuées avec des concentrations initiales différentes, ou sur une expérience au cours de laquelle on a déterminé plusieurs valeurs du temps de demi-vie.
Exemple : Vérification de l'ordre 2 à partir des temps de demi-vie
On a effectué trois expériences avec des concentrations initiales différentes et on a mesuré le temps de demi-vie pour chacune d'elles.
Les résultats sont reportés dans le tableau suivant :
Expérience | 1 | 2 | 3 |
|---|---|---|---|
CA,0 (mol.L-1) | 0,080 | 0,120 | 0,200 |
t1/2 (s) | 34 | 22 | 13 |
On constate immédiatement que le temps de demi-vie varie avec la concentration initiale, la réaction n'est donc pas du premier ordre.
Pour vérifier si elle est du second ordre, calculez le produit \(\mathbf{t_{\frac12}\times C_{\textrm A,0}}\) pour chaque expérience.
Faites ce calcul et cliquez ici[2] pour voir les résultats...
Cliquez ici[3] si vous voulez des détails.
Exemple : Vérification de l'ordre 2 à partir des temps de demi-vie
Lors de l'étude de la réaction \(\mathbf{2.\textrm A = \textrm P}\), on a suivi la variation de concentration du réactif \(\textrm A\) au cours du temps.
On a obtenu la courbe \(\mathbf{C_\textrm A = f(t)}\).
Explication :
Vérification à partir des valeurs des vitesses correspondantes à différentes concentrations
Par définition, la vitesse d'une réaction du second ordre s'écrit :
\(\mathbf{\textrm v=-\frac{1}{2}\times\frac{\textrm dC_\textrm A}{\textrm dt}=k\times C_\textrm A^2}\)
On peut donc vérifier qu'une réaction est d'ordre deux en s'assurant que sa vitesse est proportionnelle au carré de la concentration.
Remarque :
Cette vérification peut porter sur plusieurs expériences effectuées avec des concentrations initiales différentes (dans ce cas on utilise souvent les vitesses initiales), ou sur une seule expérience au cours de laquelle on a déterminé la vitesse et la concentration à différents instants.
Exemple : Vérification de l'ordre 2 à partir des vitesses
On a effectué une série de trois expériences avec des concentrations initiales différentes et on a mesuré la vitesse initiale pour chacune d'elles. Les résultats sont reportés dans le tableau suivant :
Expérience | 1 | 2 | 3 |
|---|---|---|---|
CA,0 (mol.L-1) | 0,100 | 0,180 | 0,240 |
v0 \(\times\) 104 (mol.L-1.s-1) | 7,4 | 24,0 | 42,6 |
Pour vérifier que la réaction est du second ordre, on calcule la valeur du coefficient de vitesse pour chaque expérience. Essayez de le faire pour l'une d'entre elles.
Cliquez ici[4] pour voir les résultat de ce calcul.
Cliquez ici[5] si vous désirez voir des détails.
Exemple : Vérification de l'ordre 2 à partir des vitesses
Bien que ce soit d'un usage moins fréquent, on peut aussi déterminer la vitesse à plusieurs instants d'une seule expérience.
Nous avons vu dans la quatrième partie (Loi de vitesse) des Concepts Fondamentaux que l'on peut déterminer la courbe \(\textrm v = f(t)\) à partir de la courbe \(C_\textrm A=f(t)\).
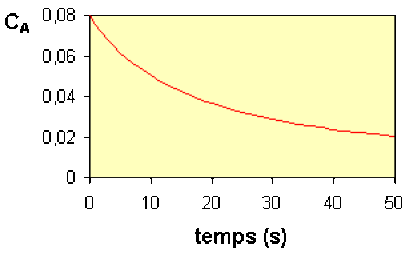
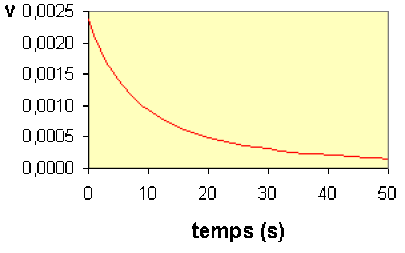
En relevant les valeurs de la vitesse et de la concentration à divers instants, on peut dresser le tableau suivant :
temps (s) | 0 | 10 | 20 | 30 | 40 | 50 |
|---|---|---|---|---|---|---|
CA | 0,080 | 0,050 | 0,037 | 0,028 | 0,024 | 0,020 |
v | 0,00240 | 0,00093 | 0,00050 | 0,00031 | 0,00021 | 0,00015 |
Pour vérifier que ces valeurs sont en accord avec la loi du second ordre \(\mathbf{\textrm v=k\times C_\textrm A^2}\) , on peut :
soit calculer la valeur du coefficient de vitesse pour chaque point et s'assurer qu'elle est sensiblement constante,
soit représenter \(\textrm v\) en fonction de \(C_\textrm A^2\) sur un graphique et s'assurer que les points s'alignent sur une droite passant par l'origine.
Cliquez ici[6] pour voir une solution numérique...
Cliquez ici[7] pour voir une solution graphique...
Explication :
Vérification à partir des valeurs de concentrations mesurées au cours du temps
La forme intégrée de la loi de vitesse du second ordre s'écrit :
\(\mathbf{\frac{1}{C_\textrm A}-\frac{1}{C_{\textrm A0}}=2.k.t}\)
On peut donc vérifier qu'une réaction est d'ordre deux en s'assurant que les valeurs de la concentration, mesurées au cours du temps, suivent bien cette relation.
Remarque :
Cette vérification peut se faire de manière numérique, en calculant pour chaque couple \(C_\textrm A,t\) la valeur du coefficient de vitesse et en s'assurant qu'elle est constante, ou de manière graphique, en traçant \(\mathbf{\frac{1}{C_\textrm A}=f(t)}\) qui doit donner une droite.
Exemple : Vérification de l'ordre 2 à partir des concentrations
Lors de l'étude d'une réaction, on a relevé les valeurs de la concentration du réactif au cours du temps. Les valeurs sont reportées dans le tableau suivant :
t (s) | 0 | 60 | 120 | 180 | 240 | 300 |
|---|---|---|---|---|---|---|
CA (mol.L-1) | 0,560 | 0,356 | 0,261 | 0,206 | 0,170 | 0,145 |
Pour vérifier que la réaction est du second ordre, on peut calculer la valeur du coefficient de vitesse pour chaque point. On trouve les résultats suivants :
t (s) | 0 | 60 | 120 | 180 | 240 | 300 |
|---|---|---|---|---|---|---|
CA (mol.L-1) | 0,560 | 0,356 | 0,261 | 0,206 | 0,170 | 0,145 |
k (L.mol-1.s-1) | 8,5 | 8,4 | 8,6 | 8,5 | 8,7 |
On constate que ces valeurs sont sensiblement constantes. La réaction est donc bien du second ordre.
Détail sur le calcul :
La loi de vitesse intégrée s'écrit : \(\frac{1}{C_\textrm A}-\frac{1}{C_{\textrm A0}}=2.k.t\)
D'où l'expression de \(k=\frac{1}{2.t}\Big(\frac{1}{C_\textrm A}-\frac{1}{C_{\textrm A0}}\Big)\)
[8] Cliquez ici[8] pour voir une solution graphique...