3 ème cas de figure
Pour une symétrie de l'environnement identique, la répartition des électrons \(d\) de l'ion de transition peut être différente.
Dans un certain nombre de cas, la théorie de la liaison de valence est simplement inadaptée. Prenons l'exemple de complexes formés à partir de l'ion métallique \(\textrm{Co}^{3+}\) de configuration électronique \(4\textrm s^0 3\textrm d^6 4\textrm p^0\).
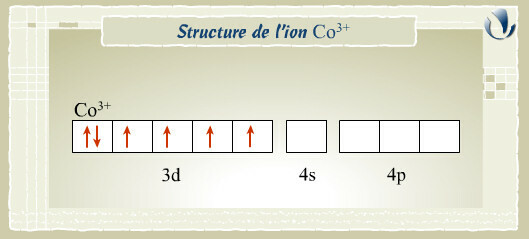
Expérimentalement, il a été prouvé (entre autre par des mesures de magnétisme), qu'en environnement octaédrique, l'ion \(\textrm{Co}^{3+}\) peut présenter 0 ou 4 électrons célibataires.
Exemple : [Co(H2O)6]^(3+) (0 électron célibataire)
Dans ce cas, le complexe ne présente aucun électron célibataire. Il est possible de rassembler les 6 électrons de \(\textrm{Co}^{3+}\) par paires dans 3 orbitales \(3\textrm d\). Les deux dernières orbitales \(3\textrm d\) restantes, qui vont être vides, vont pouvoir être hybridées avec les orbitales \(4\textrm s\) et \(4\textrm p\), vides elles aussi. Les 6 orbitales hybrides obtenues vont pouvoir former 6 liaisons avec les 6 ligands. Cette hybridation est présentée, sur la figure ci-dessous.
Le complexe \([\textrm{Co}(\textrm H_2\textrm O)_6]^{3+}\) est formé en logeant les six doublets non-liants des six molécules d'eau \(\textrm H_2\textrm O\) dans les six orbitales \(\textrm d^2 \textrm{sp}^3\) de l'ion \(\textrm{Co}^{3+}\). On vérifie bien que dans ce complexe tous les électrons sont appariés.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Exemple : [Co(F)6]^(3-) (4 électrons célibataires)
Dans ce cas, le complexe présente 4 électrons célibataires. Il est donc impossible de rassembler les 6 électrons dans 3 orbitales \(3\textrm d\). 4 orbitales \(3\textrm d\) sont simplement occupées, la dernière étant doublement occupée. Il n'y a donc plus aucune orbitale \(3\textrm d\) vide disponible pour former les 6 orbitales hybrides nécessaires à la formation du complexe. Ce cas est typiquement l'un de ceux pour lesquels la théorie de la liaison de valence trouve ses limites. Pour décrire ce type de complexe avec un grand nombre d'électrons célibataires, il est nécessaire d'utiliser les théories du champ cristallin ou des orbitales moléculaires.