Action de l'hydrogène : synthèse de l'ammoniac
La réaction-bilan de formation de l'ammoniac est :
\(\textrm N_2\textrm{(g)} + 3\textrm H_2\textrm{(g)} \leftrightarrow 2\textrm{NH}_3\textrm{(g)}\)
\(\Delta H°_{298\mathrm{K}}=-92\mathrm{kJ.mol^{-1}}\)
\(\Delta S°_{298\mathrm{K}}=-198\mathrm{J.mol^{-1}.K^{-1}}\)
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.

Un réacteur pour la synthèse de l'ammoniac
De ces données thermodynamiques, on en déduit que :
la formation de l'ammoniac est exothermique (elle dégage de la chaleur),
la réaction sera spontanée dans le sens de la formation de l'ammoniac lorsque \(\Delta G°(T)\leq{}0\), soit pour \(T\leq{}192 °\textrm C\) soit \(465 \textrm K\).
Ceci implique qu'on ne peut pas procéder à haute température. Or à basse température, la réaction est beaucoup trop lente ! On a donc recours à un catalyseur, à base de fer ou d'autres métaux, qui active la rupture des liaisons dans les molécules de \(\textrm N_2\), \(\textrm H_2\) et \(\textrm{NH}_3\). C'est le procédé Haber.
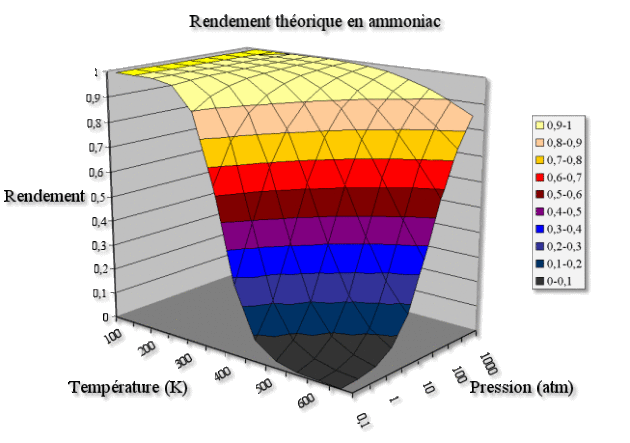
On peut calculer de façon précise le rendement théorique en ammoniac pour différentes valeurs de la pression et de la température, comme indiqué au graphe ci-dessus. Lorsque le rendement vaut 0,5 et la pression vaut 1, on retrouve la température d'inversion de \(465 \textrm K\).
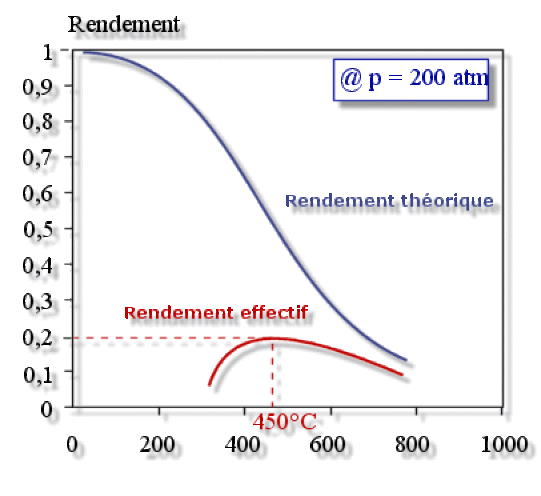
En fait, à cause des limitations cinétiques, on opère à une température de \(450 °\textrm C\) pour une pression de \(200 \textrm{atm}\), comme le suggère le graphe ci-dessous :