Action directe de l'oxygène : oxydes d'azote
A très haute température seulement (par exemple lors d'un arc électrique ou de la décharge d'un éclair, vers \(2000 °\textrm C\)), on a :
\(\textrm N_2\textrm{(g)} + \textrm{O}_2\textrm{(g)} \leftrightarrow 2.\textrm{NO}_\textrm{(g)} \Delta H°_{298\textrm K} = +43 \textrm{kJ.mol}^{-1}\)
Comme cette réaction est endothermique, on comprend qu'il faille refroidir \(\textrm{NO}\) pour pouvoir le conserver, faute de quoi il redonne les réactifs, ou bien il réagit lui-même sur le dioxygène pour donner \(\textrm{NO}_2\)
Complément : Oxydation du NO
\(\textrm{NO}\) est directement oxydable à froid par le dioxygène :
\(\textrm{NO}\textrm{(g)} + \frac12 .\textrm O_2 \textrm{(g)} \to \textrm{NO}_2\textrm{(g)}\)
complète pour \(\textrm T<150 °\textrm C\)
A cause de cette dernière réaction, on n'a jamais de \(\textrm{NO}\) pur dans l'air, mais plutôt un mélange de \(\textrm{NO}\), et \(\textrm{NO}_2\) autres, que l'on a pris l'habitude d'appeler "\(\textrm{NO}_\textrm x\)"
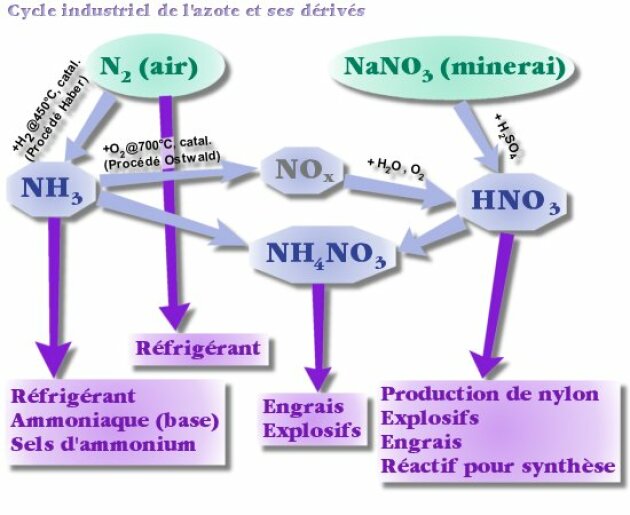
Dans la pratique, ce n'est pas cette réaction que l'on utilise pour obtenir industriellement des oxydes d'azote, nécessaires dans la fabrication des engrais et réactifs pour la chimie organique.
C'est cependant cette réaction-ci qui est à l'origine des problèmes d'émission des oxydes d'azote par les moteurs à combustion : en effet, des températures supérieures à \(2000 °\textrm C\) peuvent être atteintes très localement dans une flamme de combustion d'un hydrocarbure ; si de plus le mélange de gaz employé est pauvre en hydrocarbure et contient du diazote, alors on produit du \(\textrm{NO}\) et d'autres oxydes d'azote.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
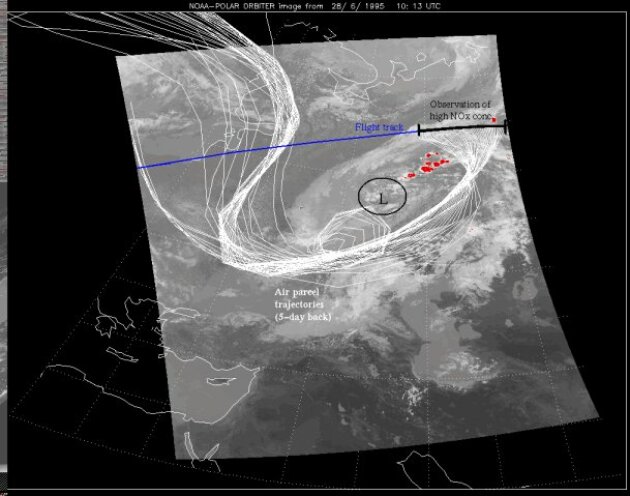
Sur cette photo (cliché NOAA), on voit une carte de l'Asie mineure et des pays slaves : un avion passe sur la trajectoire marquée en bleu, il émet des NOx sur son passage, qui sont ensuite dispersés par les courants aériens (blanc) qui s'enroulent autour d'une dépression (ovale marqué L).