Propriétés microscopiques et physiques
La forme la plus courante de l'oxygène est la molécule de dioxygène \(\textrm O_2\). Elle est à l'état gazeux à température ambiante. La température d'ébullition de \(\textrm O_2 \textrm{(l)}\) est de \(90 \textrm K\) (\(-183 °\textrm C\)) et sa température de solidification est de \(54 \textrm K\) (\(-219 °\textrm C\)).
Structure de la molécule
La configuration électronique du dioxygène est : \(1\textrm s^22\textrm s^22\textrm p^2_x2\textrm p^1_y2\textrm p^1_\textrm z\). Son diagramme d'O.M. est le suivant :
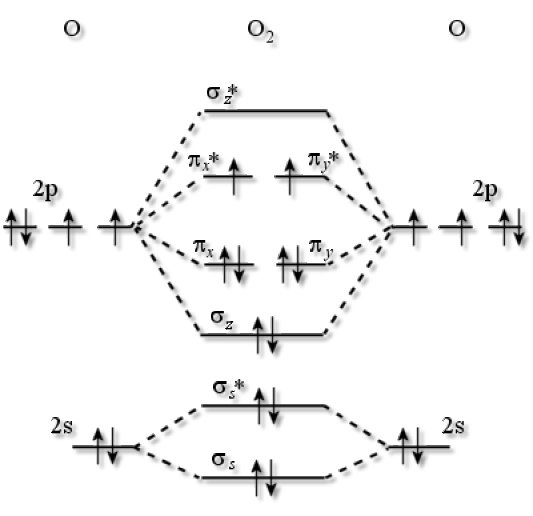
Afin de respecter la règle de Hund, les deux électrons du niveau le plus élevé occupent seuls chacune des deux orbitales \(\pi^*_{2\textrm p_\textrm x}\) et \(\pi^*_{2\textrm p_\textrm y}\). La molécule de dioxygène présente huit électrons liants et quatre électrons antiliants. L'ordre de liaison est égal à deux. Il y a donc une double liaison \(\textrm O=\textrm O\) dans la molécule de dioxygène.
Le diagramme d'O.M. du dioxygène présente deux électrons non appariés distribués dans les deux O.M. antiliantes. Ceci lui confère des propriétés paramagnétiques.
Mais il y a une faible différence d'énergie avec un état diamagnétique (\(\pi^*_{2\textrm p_\textrm x}\textrm{}^2\pi^*_{2\textrm p_\textrm y}\textrm{}^0\), oxygène « singulet ») ; la transition entre ces deux états correspond à l'absorption de photons visibles (orange). Le dioxygène pur (liquide) paraît donc bleu, car c'est une couleur complémentaire de l'orange.
Dans \(\textrm O_2\) liquide, une légère dimérisation est possible :
\(2.\textrm O_2 \textrm {(l)}\textrm { }\textrm {}^\to_\gets \textrm { }\textrm O_4 \textrm {(l)}\) par l'intermédiaire des électrons antiliants
Par conséquent, on a une température d'ébullition pour \(\textrm O_2\) supérieure à celle de \(\textrm N_2\).
Remarque :
la distance \(d_{\textrm O-\textrm O}\) dépend de l'ordre de la liaison \(\textrm O-\textrm O\)
\(\mathrm{O^+_2}\) | \(\mathrm{O_2}\) | \(\mathrm{O^-_2}\) | \(\mathrm{O^{2-}_2}\) | |
Nom | ion dioxygényle | dioxygène | ion superoxyde | ion peroxyde |
Ordre de liaison | 2,5 | 2 | 1,5 | 1 |
\(d_{\mathrm{O-O}}(\AA)\) | 1,12 | 1,21 | 1,30 | 1,49 |
Magnétisme | PARA | PARA | PARA | DIA |