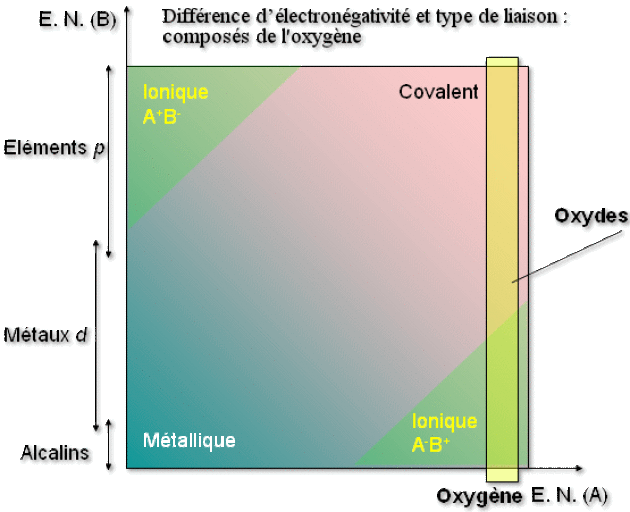
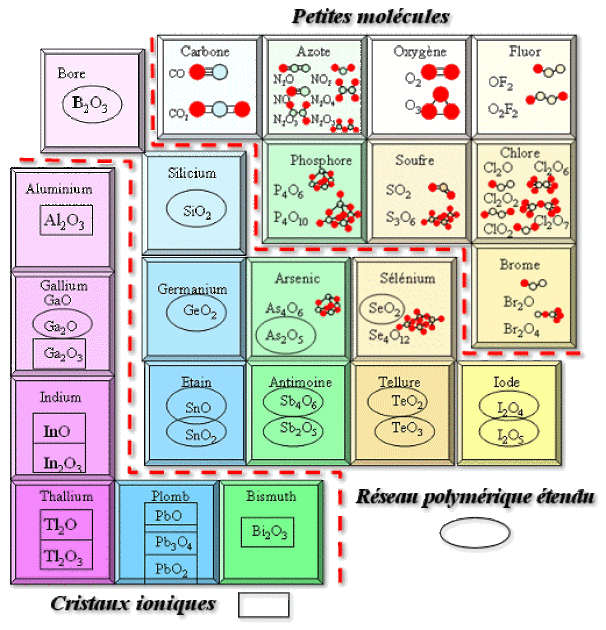
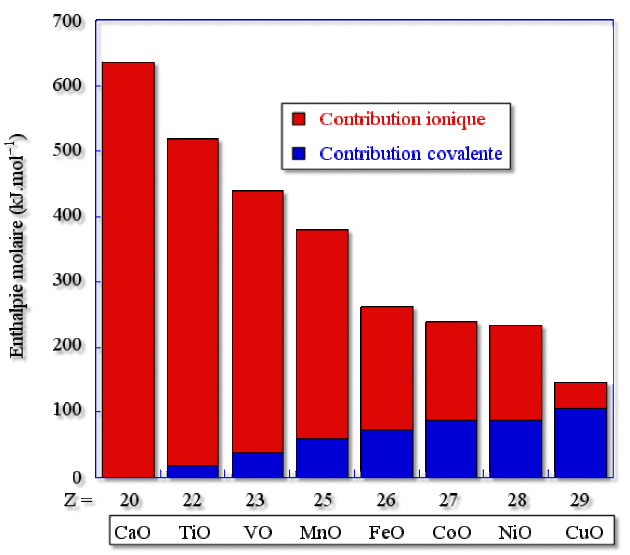
Type de liaison
Comme l'oxygène est très électronégatif, il ne peut établir que des liaisons ioniques ou covalentes avec les autres éléments, comme indiqué ci-dessous :
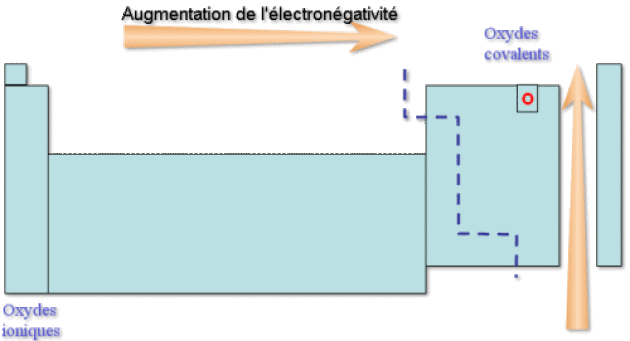
Le caractère covalent de la liaison \(\textrm M-\textrm O\) augmente au sein du tableau périodique de gauche à droite et de bas en haut (position de \(\textrm M\)), c'est-à-dire à l'inverse de la différence d'électronégativité entre \(\textrm M\) et \(\textrm O\), comme indiqué ci-dessous :
Plus précisément, pour les éléments \(p\), on a les structures suivantes :
Les oxydes ioniques ou covalents 3D ont des températures de fusion élevées (destruction d'un réseau stable). En revanche, les oxydes moléculaires (0D, 1D) ont des \(T_f\) basses, car ils sont constitués de molécules reliées entre elles par des liaisons faibles, comme les liaisons de Van der Waals. On peut le voir sur le tableau suivant :
\(\mathrm{Na_2O}\) | \(\mathrm{MgO}\) | \(\mathrm{Al_2O_3}\) | \(\mathrm{SiO_2}\) | \(\mathrm{P_4O_{10}}\) | \(\mathrm{SO_3}\) | \(\mathrm{Cl_2O_7}\) | |
Etat à 25°C | Solide | Solide | Solide | Solide | Solide | Liquide | Liquide |
\(T\mathrm{_{{f}}~(°C)}\) | 920 | 2770 | 2030 | 1710 | 360 (subl) | 17 | -95 |
Pour un même degré d'oxydation, on peut ainsi remarquer que le caractère covalent augmente en passant des oxydes alcalins et alcalino-terreux aux oxydes de métaux nobles (voir figure ci-dessous). En effet, lorsque la taille de \(\textrm M\) diminue, son pouvoir polarisant augmente (proportionnel à \(\frac{q}{r^2}\)) et la covalence augmente.
Lorsque c'est la charge du cation qui augmente (ou le degré d'oxydation), alors on constate la même tendance : la taille du cation diminue, son pouvoir polarisant augmente, et la liaison devient de plus en plus covalente. Ainsi, dans le tableau suivant, on constate que la température de fusion des oxydes de Manganèse diminue avec le degré d'oxydation.
\(\mathrm{MnO}\) | \(\mathrm{Mn_2O_3}\) | \(\mathrm{MnO_2}\) | \(\mathrm{Mn_2O_7}\) | |
Degré d'oxydation de Mn | +II | +III | +IV | +VII |
\(T\mathrm{_{{f}}~(°C)}\) | 1785 | 940 | 535 | 6 |
Solide ionique | ||||