Structure
Le rayon de l'oxygène augmente avec le caractère ionique (qui est lié à la probabilité de présence des deux électrons autour du noyau). Lorsque cette probabilité se rapproche de 100 % (ion \(\textrm O^{2-}\)), l'énergie de répulsion entre les électrons augmente, ce qui entraîne une augmentation de la taille.
\(R_{cov}\left(\textrm{O}\right)\sim0,74\AA~~~-~~~R_{ion}\left(\mathrm{O^{2-}}\right)\sim1,40\AA\)
La coordinence de \(\textrm O\) est supérieure lorsque la liaison est ionique. En effet, celle-ci se base sur l'attraction entre anions et cations, dont les nuages électroniques s'interpénètrent peu (modèle des sphères dures), tandis que la liaison covalente se base sur la localisation des électrons de liaison sur des orbitales moléculaires peu nombreuses et situées entre les atomes liés. Par ailleurs, lorsque le caractère ionique de la liaison augmente, la taille de l'oxygène augmente, ce qui favorise les coordinences élevées.
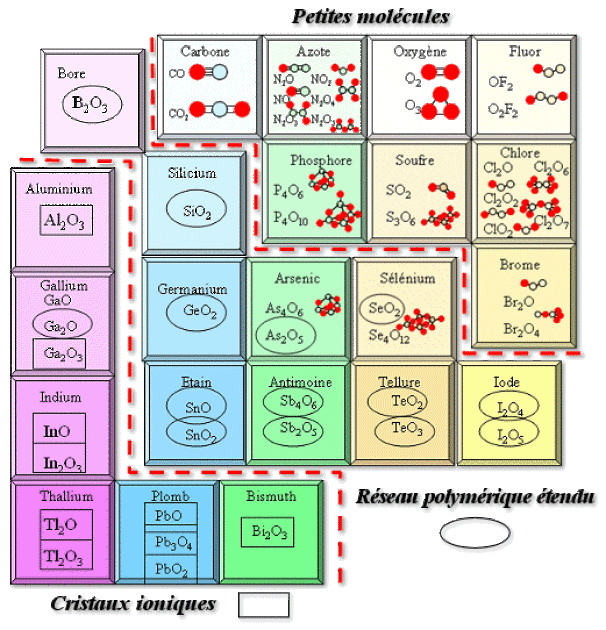
Quelques structures d'oxydes :
Lorsque la liaison est à caractère ionique prédominant, on a des édifices plutôt tridimensionnels, par exemple :
Oxyde | Structure | Coordinence O | |
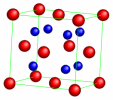
\(\mathrm{ Na_2O}\) | antifluorine | [8] | |
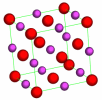
\(\mathrm{CaO}\) | NaCl | [6] | |
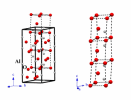
\(\alpha - \mathrm{Al_2O_3}\) | corindon | [6] | |
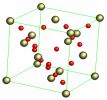
\(\beta - \mathrm{SiO_2}\) | cristobalite | [2] |
Au contraire, lorsque la liaison est plutôt covalente, on obtient des cristaux à faible cohésion car reposant sur les forces de Van der Waals. On peut les qualifier d'édifices « 0D », comme dans le tableau ci-dessous. La situation intermédiaire entre ionique et covalent amène à des dimensionnalités intermédiaires :
en chaînes (1D) : \(\textrm{Sb}_2\textrm O_5\),
en feuillets (2D) : \(\gamma-\textrm{As}_4\textrm O_6\), \(\textrm{SnO}\).