Principe
En milieu aqueux, le demi-couple associé au dioxygène est le moteur de corrosion :
\(\textrm O_2 \textrm{(g)}+4.\textrm H^+ \textrm{(aq)}+4.\textrm e^- \leftrightarrow 2.\textrm H_2\textrm O\textrm{ } \textrm{ }E°=+1\textrm,23 \textrm{V/ENH}\)
\(E\) est une fonction du \(\textrm{pH}\) (dans la pratique, le dioxygène passe par un état dissous)
Remarque :
Le potentiel de ce couple dépend du \(\textrm{pH}\) puisque \(\textrm H^+\) entre dans l'équilibre. Ainsi, à \(25 °\textrm C\):
\(E\textrm{(pH)}=E°-\Big(\frac{RT\ln10}{F}\Big)\times\textrm{pH}=E°-0\textrm,06\times\textrm{pH}\)
La molécule de dioxygène \(\textrm O_2\) est susceptible d'oxyder de nombreux réducteurs (tels que leur potentiel d'équilibre redox \(E\) est inférieur à 1,23 V), mais la réaction est souvent extrêmement lente à température ambiante.
Voici quelques métaux bien connus, pour lesquels les potentiels standard des couples en milieu acide sont donnés :
Exemple :
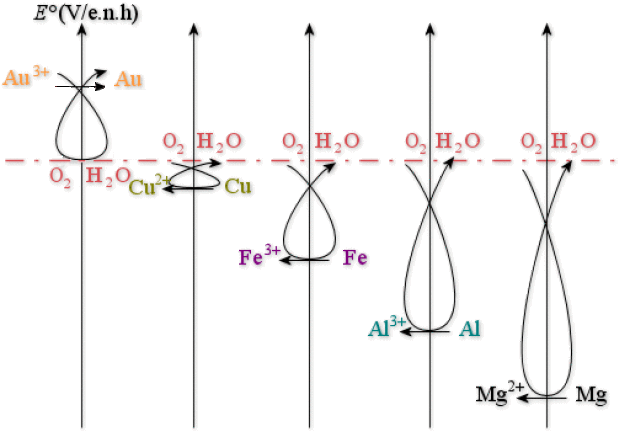
On voit donc que :
L'or n'est pas attaqué par l'oxygène dans l'eau (c'est pour cela aussi que c'est un métal « noble »). Il faudrait un oxydant plus puissant.
Le cuivre, le fer, l'aluminium et le magnésium peuvent être corrodés. La différence entre ces métaux provient de la cinétique de corrosion. En particulier, les oxydes et/ou hydroxydes formés sont solides et forment une couche plus ou moins poreuse sur le métal. Si cette couche est adhérente et dense, elle est protectrice : on parle alors de passivation ; c'est le cas de l'aluminium et, dans une moindre mesure, du cuivre. Par contre, sur le fer, l'oxyde/hydroxyde est poreux et faiblement adhérent (c'est la rouille) : celui-ci n'empêche donc pas la corrosion.