Préparation
L'eau oxygénée \(\textrm H_2\textrm O_2\) est généralement obtenue par hydrolyse sous pression réduite de peroxodisulfate \(\textrm S_2\textrm O_8^{2-}\) suivant la réaction :
\(\textrm S_2\textrm O_8^{2-}+2.\textrm H_2\textrm O\to2.\textrm{HSO}_4^-+\textrm H_2\textrm O_2\) (solution à 30 % d'\(\textrm H_2\textrm O\))
Ou par oxydation d'éthyl-2-anthrahydroquinone.
L'eau oxygénée \(\textrm H_2\textrm O_2\) est ensuite récupérée par distillation fractionnée. La structure de la molécule est décrite sur la figure suivante :
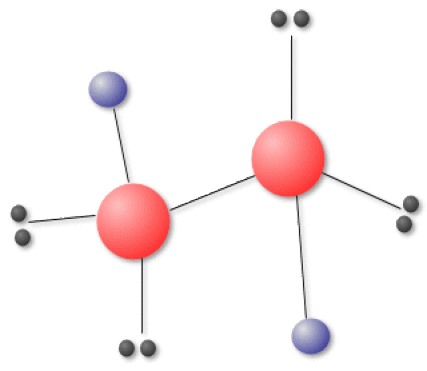
\(\textrm d_ {\textrm O-\textrm H}=96 \textrm{pm}\) (valeur peu différente de celle de \(\textrm d_ {\textrm O-\textrm H}\) dans la molécule \(\textrm H_2\textrm O\)). \(\textrm{d}_ {\textrm{O}-\textrm{O}}=147 \textrm{pm}\) (comme dans l'ion peroxyde \(\textrm O_2^{2-}\)). La molécule \(\textrm H_2\textrm O_2\) est une molécule à moment dipolaire élevé \(\mu=1\textrm,57 \textrm{Debye}\) (existence de paires libres et polarisation de la liaison \(\textrm O-\textrm H\)).
A l'état solide, \(\textrm H_2\textrm O_2\) présente des liaisons hydrogène comme \(\textrm H_2\textrm O\), ce qui explique les températures de changement d'état suivantes : \(T_f=-0\textrm,4 °\textrm C\) et \(T_{eb}\approx150 °\textrm C\).