Stabilité des espèces
Sur le diagramme de Pourbaix du chlore on a ajouté la droite \(E=1\textrm,23-0\textrm,06 \textrm{pH}\) qui correspond à l'oxydation de l'eau en dioxygène.
On remarque en premier lieu que les composés \(\textrm{Cl}_2\), \(\textrm{HClO}\) et \(\textrm{ClO}^-\) sont des oxydants très puissants quel que soit le \(\textrm{pH}\). Leurs domaines d'existence sont au-dessus de celui de l'eau, cela signifie donc que, d'un point de vue thermodynamique, \(\textrm{Cl}_2\), \(\textrm{HClO}\) et \(\textrm{ClO}^-\) sont capables d'oxyder l'eau, ce qui entraînerait un dégagement de dioxygène \(\textrm O_2\). Or, cinétiquement, ces réactions d'oxydation de l'eau sont très lentes, sauf en présence d'un catalyseur (par exemple une surface métallique).
En solution aqueuse la forme stable du chlore est \(\textrm{Cl}^-\).
En milieu acide \(\textrm{HClO}\), et \(\textrm{Cl}^-\) ne peuvent coexister, il y a médiamutation et formation de \(\textrm{Cl}_2\). On avait fait déjà cette observation à la vue du diagramme de Frost.
Dès que le milieu n'est plus très acide, \(\textrm{Cl}_2\) se dismute en \(\textrm{HClO}\) et \(\textrm{Cl}^-\) pour les \(\textrm{pH}\) inférieurs à 7,5 et en \(\textrm{ClO}^-\) et \(\textrm{Cl}^-\) pour les \(\textrm{pH}\) supérieurs à 7,5. On avait déjà mentionné ce fait lors de la présentation de l'électrolyse du chlorure de sodium.
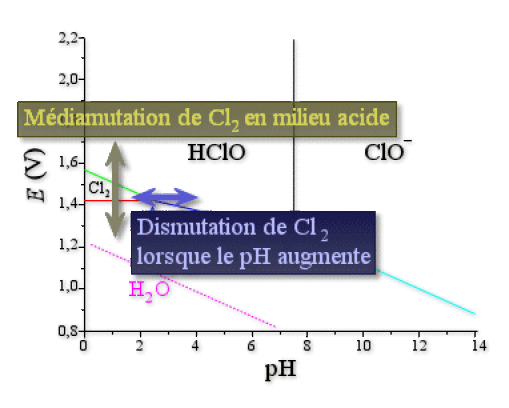
Toutes ces observations ne tiennent pas compte de la cinétique des réactions.
Par ailleurs, les frontières dépendent des concentrations des espèces.
Les tendances données sont cependant vérifiées par l'expérience avec une vitesse plus ou moins grande.