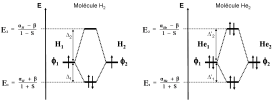Orbitales Moléculaires d'une molécule diatomique homonucléaire
Partie
On suppose que les deux noyaux de deux atomes de même type sont maintenus à une distance fixe (ce qui revient à appliquer l'approximation de Born-Oppenheimer). Considérons donc deux OA de même type provenant de chacun des deux atomes et formant une liaison.
Les orbitales moléculaires s'écrivent selon :
et sont solution de l'équation de Schrödinger : H\(\Psi\) = E\(\Psi\) qui s'écrit encore :
But général : donner les expressions analytiques des orbitales et de l'énergie.
On définit :
Avec
- \(\alpha\) i les intégrales coulombiennes, elles représentent en première approximation l'énergie d'un électron occupant l'orbitale \(\phi\) i dans l'atome i isolé. \(\alpha\) i est négative et sa valeur absolue doit croître avec l'électronégativité de A
- \(\beta\) ij les intégrales de résonnance, Sa valeur absolue donne une mesure de la force de la liaison entre les deux atomes. C'est une fonction croissante de l'intégrale de recouvrement S12.
- Sij les intégrales de recouvrement.
Question
Écrire la condition sur les énergies et les coefficients.
Solution détaillée
Intégrons l'expression de l'orbitale moléculaire dans l'équation de Schrödinger :
Lorsque i=j, on obtient : Sii = 1car les orbitales atomiques sont normées, soit S11 = S12 = 1. De plus, comme ici les deux atomes, et les deux orbitales, 1 et 2 sont de même type, on a : \(\alpha\) 1=\(\alpha\) 2 que l'on notera \(\alpha\), et \(\beta\) 12=\(\beta\) 21 que l'on notera \(\beta\).
On obtient :
Finalement, on obtient la condition suivante sur les énergies et les coefficients c1 et c2 :
Une nouvelle fois, cette équation est généralisée et donc valable pour toutes les orbitales moléculaires, c'est-à-dire pour tout les couples {E,(c1,c2)}. Dans la suite de la démonstration, il faudra donc garder en mémoire quelle solution on recherche.
Question
Les inconnues de cette équation sont c1, c2 et E. Déterminer les expressions des énergies.
Pour cela, on s'appuiera sur la méthode variationelle. Pour minimiser E, on différencie et on annule les dérivées partielles :
Solution détaillée
On obtient le système d'équation suivant :
qui n'accepte de solutions non triviales que si son déterminant associé est nul :
qui se développe selon :
les solutions s'écrivent alors:
\(\alpha\) et \(\beta\) ont des valeurs négatives et S étant par nature inférieur à 1 (valeur qui correspondrait à un recouvrement parfait de l'orbitale 2 sur l'orbitale 1), ces deux énergies sont négatives. E1 est plus basse que E2.
Question
Écrire les expressions des deux orbitales moléculaires
Afin de trouver les orbitales associées à chacun de ces niveaux énergétique, il faut ré-injecter chacune des valeurs d'énergie dans le système d'équations. Une condition supplémentaire, la condition de normation, sera nécessaire pour déterminer complètement le jeu de coefficients de chacune des orbitales. Celle-ci s'écrit :
Solution détaillée
En injectant E1 dans le système d'équation, nous obtenons :
ou encore :
soit c1 = c2.
En réinjectant cette dernière condition dans l'équation de la condition de normation, on obtient la valeur des deux coefficients des orbitales atomiques, c1 et c2, permettant de définir l'orbitale moléculaire, que l'on notera \(\Psi\) 1, qui est associée au niveau de plus basse énergie, E1:
Le même traitement appliquée avec l'énergie E2 nous donne les résultats suivants :
Les deux orbitales moléculaires s'écrivent :
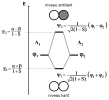
On peut alors regrouper les résultats sur un diagramme d'énergie des Orbitales Moléculaires :
Analyse des orbitales moléculaires
Les signes de chacun des objets mathématiques représentant les orbitales atomiques sont importants dans le cadre de leur combinaison linéaire en vue de la formation des orbitales moléculaires. Il est généralement considéré qu'initialement ces fonctions ont même signe.
Les deux orbitales \(\phi\) 1 et \(\phi\) 2 sont identiques, elles pèsent le même poids dans les orbitales moléculaires. Ces dernières seront donc symétriques.
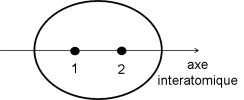
Si l'on considère les combinaisons des orbitales atomiques dans les expressions des orbitales moléculaires, il apparaît que les fonctions des deux orbitales atomiques se recouvrent dans l'espace interatomique. La nature de ce recouvrement déterminera la nature de l'orbitale moléculaire considérée.
L'orbitale \(\Psi\) 1 : dans l'espace interatomique, les fonctions s'ajoutent. La probabilité de trouver les électrons dans cette zone de l'espace augmente également. On peut donc considérer en première approximation qu'il s'agit d'un partage de deux électrons dans l'espace interatomique : C'est la définition d'une liaison. \(\Psi\) 1 est une orbitales moléculaire liante.
On peut tenter de dessiner l'enveloppe globale que prendrait cette orbitale moléculaire liante :
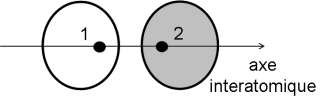
L'orbitale \(\Psi\) 2 : dans l'espace interatomique, les fonctions se retranchent. On peut également considérer que l'on ajoute une fonction \(\phi\) 1 positive à une fonction (-\(\phi\) 2) négative. Les fonctions mathématiques définissant \(\phi\) 1 et \(\phi\) 2 sont les mêmes, donc, exactement à équidistance des noyaux des atomes 1 et 2, cette somme est nulle. Cette surface, associée à une fonction d'onde (orbitale moléculaire \(\Psi\) 2) nulle, s'appelle une surface nodale. Sur cette surface, la probabilité de trouver les électrons dans cette partie de l'espace est nulle.\(\Psi\) 2est une orbitales moléculaire antiliante.
On peut tenter de dessiner l'enveloppe globale que prendrait cette orbitale moléculaire antiliante :
Analyse des énergies
Chaque orbitale atomique \(\phi\) 1 et \(\phi\) 2 est associée à un niveau énergétique de valeur \(\alpha\) . Les énergies des orbitales moléculaires, E1 et E2, sont réparties de part et d'autres de cette valeur intermédiaire (attention, ce n'est pas la moyenne). La différence entre \(\alpha\) et E1 est alors plus faible que celle entre \(\alpha\) et E2.
Cette différence est importante, car elle peut expliquer la stabilité des molécules par rapport aux atomes séparés mais aussi le fait que certaine molécule ne sont pas stables.
Considérons les deux molécules H2 et He2. Toutes deux rentrent dans le cas simple de la molécule diatomique homonucléaire et de plus mettent en jeux les mêmes orbitales atomiques ( les orbitales 1s).
Ci-dessous, les diagrammes énergétiques des orbitales moléculaires de ces deux molécules (étude qualitative).
Molécule H2 : chaque atome d'oxygène (Z=1) apporte 1 électron à placer dans les orbitales moléculaires. Les deux électrons seront donc placées dans l'orbitale moléculaire liante, car elle est de plus basse énergie.
Bilan énergétique pour la création de H2 :
L'état initial correspond à deux atomes d'hydrogène séparés. Son énergie vaut : EI = 2*EH = 2*\(\alpha\)
L'état final est une molécule de H2. Son énergie est : EF = EH2 = 2*E1 + 0*E2
Le bilan donne : EF -EI = 2*E1-2*\(\alpha\) = 2 (E1 – \(\alpha\) ) <0
La molécule de H2 est prédite comme étant stable.
Molécule He2 : chaque atome d'hélium (Z=2) apporte 2 électrons à placer dans les orbitales moléculaires. Les quatre électrons seront donc placées dans les orbitales moléculaires liantes et antiliantes.
Bilan énergétique pour la création de He2 :
L'état initial correspond à deux atomes d'hélium séparés. Son énergie vaut : EI = 2*EHe = 4*\(\alpha\)
L'état final est une molécule de He2. Son énergie est : EF = EHe2 = 2*E1 + 2*E2
Le bilan donne : EF-EI = 2*E1 + 2*E1-4*\(\alpha\) = 2 (E1 – \(\alpha\) )+ 2 (E2 – \(\alpha\) )>0
La molécule de He2 est prédite comme étant instable.