1/ Localisation d'orbitales - Orbitales localisées du méthane
Partie
La molécule de méthane, CH4, possède une géométrie tétraédrique qui peut être insérée dans un cube, comme présenté dans la figure ci-dessous :
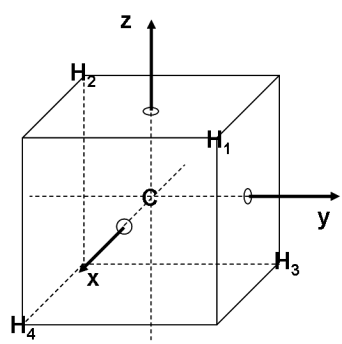
L'atome de carbone occupe le centre du cube alors que les quatre atomes d'hydrogène occupent quatre des huit sommets. Ces derniers sont donc à équidistance de l'atome de carbone.
Les orbitales atomiques du carbone jouant dans la construction des orbitales moléculaires sont les orbitales 2sc, 2pxc, 2pyc et 2pzc. Chaque orbitale 1s (notées 1s1, 1s2, 1s3 et 1s4) des atomes d'hydrogène seront également impliquées dans les orbitales moléculaires.
L'atome de carbone possède 4 électrons de valence, les atomes d'hydrogène n'en possèdent qu'un. Nous disposons donc de 8 électrons à distribuer dans les orbitales moléculaires.
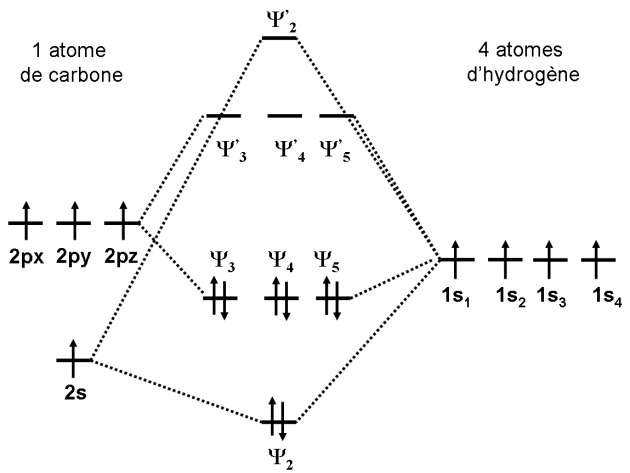
Qualitativement, le diagramme d'énergie des orbitales moléculaires peut être représenté comme suit :
Un calcul de chimique quantique sur la molécule de méthane a permis de déterminer les orbitales moléculaires de ce système. Les coefficients des orbitales atomiques définissant les orbitales moléculaires occupées sont présentées dans le tableau ci-dessous :

En négligeant les coefficients de faible valeur (faible implications des OA dans l'OM considérée), on obtient les expressions analytiques suivantes pour chacune des OM :
L'orbitale\(\Psi\) 1 est clairement constituée uniquement de l'orbitale 1s de l'atome de carbone. Celle-ci, beaucoup plus profonde en énergie ne joue aucun rôle dans la construction des orbitales moléculaires.
Question
Dessiner schématiquement les orbitales moléculaires\(\Psi\) 2,\(\Psi\) 3,\(\Psi\) 4 et \(\Psi\) 5
Solution détaillée
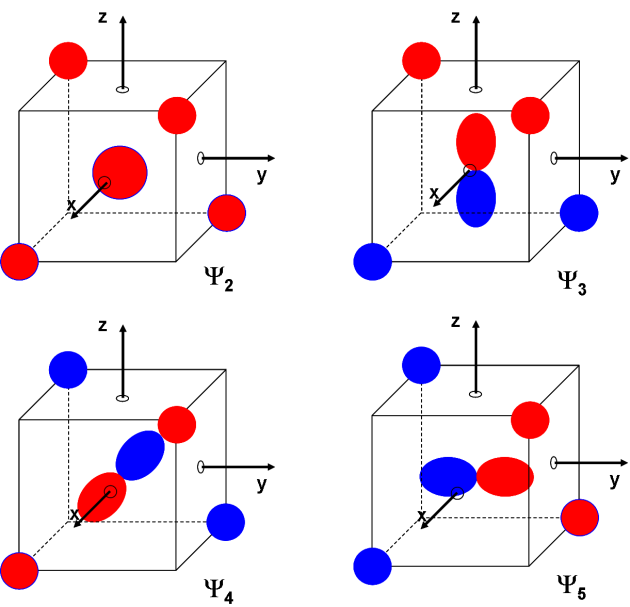
En considérant que les différences de signes mathématiques peuvent être représentés par des couleurs différentes (par exemple rouge : positif et bleu : négatif), nous pouvons schématiser comme suit les orbitales moléculaires :
Ces orbitales moléculaires sont délocalisées, c'est-à-dire que chacune d'entre-elles ne définit pas une liaison, mais prises toutes ensembles, elles définissent tous les modes de liaison dans la molécule de méthane.
Cette représentation n'est pas celle qui est communément utilisée quand on décrit une molécule, ou plus précisément les liaisons dans une molécule. Généralement, on utilise une représentation faisant intervenir des orbitales hybridées.
Question
Ecrire une combinaison linéaire \(\Psi\) 2,loc des orbitales \(\Psi\) 2,\(\Psi\) 3,\(\Psi\) 4 et \(\Psi\) 5 qui ne fasse apparaître que l'orbitale 1s1 de l'atome d'hydrogène 1. Répéter l'opération pour les orbitales 1s2, 1s3 et 1s4.
Solution détaillée
\(\Psi\) 2,loc s'obtient facilement :
Suivant la même procédure, on obtient :
Une fois normées, les nouvelles orbitales s'écrivent :
Considérons par exemple \(\Psi\) 2,loc La seule orbitale provenant des atomes d'hydrogène qui y apparaît est 1s1 (provenant de l'oxygène H1). Pour le carbone, les quatre orbitales atomiques de valence (2s, 2px, 2py et 2pz) participent de façon équivalente. Cette fonction mathématique décrit une interaction uniquement entre l'atome d'hydrogène H1 et le carbone.
Que représente cette combinaison linéaire des orbitales de valence du carbone ? Réfléchissons en deux temps en combinant les fonctions mathématiques de deux orbitales atomiques différentes :
Ainsi, sans penser aux objets qu'elles représentent, les combinaisons des différentes expressions analytiques donneraient les objets suivants :
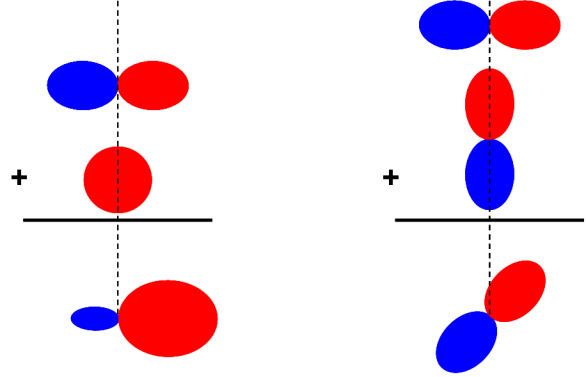
Le "mélange" d'une fonction mathématique décrivant une orbitale s (sphérique) et d'une orbitale p (bilobale) donne une fonction qui reste bilobale mais non symétrique. La partie de l'espace où les deux fonctions ont le même signe s'ajoutent et celles où les signes sont opposés se retranchent. Il s'ensuit la création d'une partie de l'espace où la probabilité de trouver notre particule est augmentée et une autre où cette probabilité est diminuée.
Le mélange de deux fonctions mathématiques décrivant chacune une orbitale p mais orthogonale l'une a l'autre tend à augmenter la probabilité dans l'espace entre ces deux fonctions. On trouve au final un fonction mathématique qui ressemble fortement à nos fonctions bilobales initiales (orbitale de type p) mais qui a changé de sens.
Nous venons de créer une orbitale hybridée. Dans \(\Psi\) 2,loc. le carbone fait intervenir les quatre orbitales atomiques 2s, 2px, 2py et 2pz qui permettent la création d'une orbitale hybride sur cette atome : une orbitale hybridée sp3.
Question
Dessiner schématiquement (dans un cube comme dessiné ci-dessus) les orbitales moléculaires \(\Psi\) 2,loc, \(\Psi\) 3,loc, \(\Psi\) 4,locet \(\Psi\) 5,loc
Solution détaillée
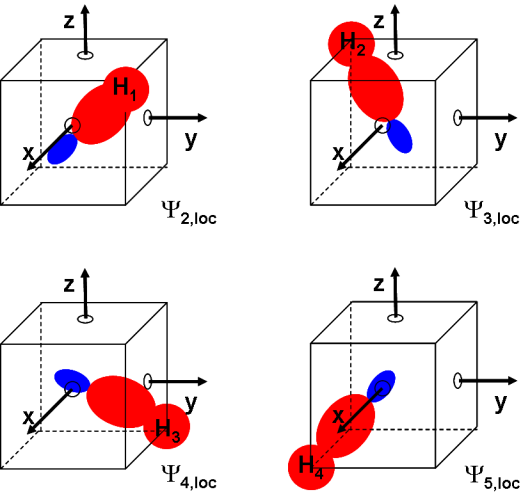
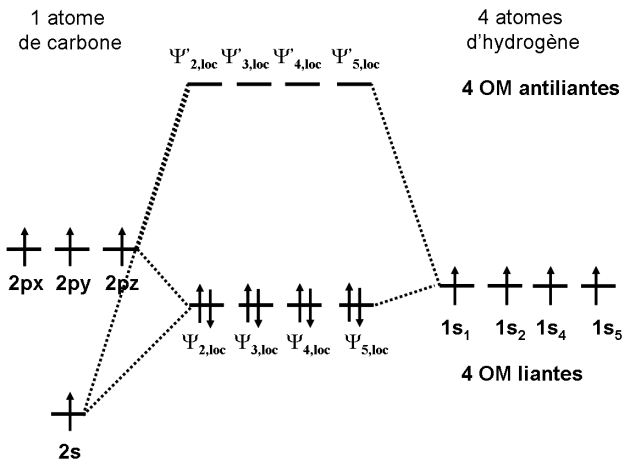
Dans chacune des 4 orbitales moléculaires, la combinaison des orbitales 2s, 2px, 2py et 2pz de l'atome de carbone entraîne la création d'une orbitale hybride sp3. Nous en avons obtenu quatre au total, chacune d'entre elles pointant vers l'un des atomes d'hydrogène.
Ces quatre orbitales moléculaires sont donc localisées. Chacune décrit une des quatre liaisons CH dans le méthane.
Question
Dessiner schématiquement le diagramme des énergies des Orbitales Moléculaires localisées.
Solution détaillée
Au niveau énergétique, les quatre nouvelles orbitales sont à la même énergie car elles proviennent d'une même pondération entre les différentes orbitales atomiques.
Nous avons donc maintenant quatre orbitales moléculaires localisées équivalentes, représentant les quatre liaisons équivalentes CH. Nous sommes maintenant devant la description classique de la molécule de méthane telle qu'elle est utilisée en Chimie.