Spectroscopies électroniques
Spectroscopies électroniques Les spectroscopies électroniques sont de loin les plus anciennes. Elles peuvent être sommairement décrites, pour une grande partie d'entre elles, comme des spectroscopies d'absorption conduisant à un état excité de l'électron sans émission de ce dernier. Elles s'intéressent donc à des transitions qui concernent des électrons éloignés du noyau, parfois de valence, et elles opèrent dans le domaine de l'ultraviolet et du visible.
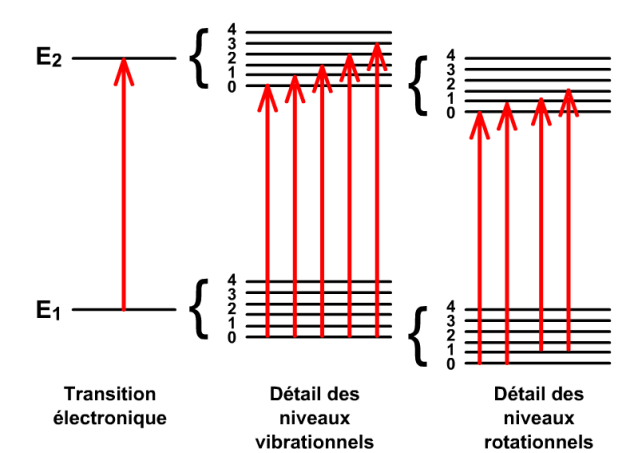
Dans ces domaines d'énergie, s'agissant des molécules, on retient le nom de spectroscopie moléculaire dans l'UV et le visible. Dans un atome, une variation de l'énergie électronique donne naissance à une seule raie spectrale. Dans une molécule une telle variation est aussi associée à une modification des énergies de vibration et de rotation, ce qui conduit à des spectres de bandes, on a :
\(\textrm h\nu=\textrm h(\nu_\textrm e+\nu_{\textrm{vib}}+\nu_{\textrm{rot}})\)
Les fréquences associées étant pour
\(\nu_\textrm e\) : de \(3. 10^{12}\) à \(3. 10^{13} \textrm{Hz}\) (niveau électronique)
\(\nu_{\textrm{vib}}\) : de \(15 .10^{10}\) à \(3. 10^{12}\textrm{ Hz}\) (niveau vibratoire)
\(\nu_{\textrm{rot}}\) : de \(3. 10^{10}\) à \(6. 10^{10} \textrm{Hz}\) (niveau rotatoire)
On observe donc les fréquences de transitions électroniques les plus élevées, “élargies“ par les énergies beaucoup plus faibles des niveaux de vibrations et de rotations moléculaires.
Les énergies utilisées dans ce domaine (UV-visible) permettent de promouvoir vers des états excités des électrons essentiellement de valence (couche externe) et donc impliqués, soit dans des liaisons (simple et multiples), soit non liés (paires libres).
La spectroscopie UV-visible est virtuellement constituée de deux sous domaines (ie : l'UV et le visible) en raison de la sensibilité particulière de l'oeil humain à une fraction du champ électromagnétique, le domaine visible s'étendant du violet ( \(\lambda= 420 \textrm{nm}\) et \(\nu= 7,1. 10^{14} \textrm{Hz}\)) au rouge (\(\lambda = 750 nm\) et \(\nu= 4. 10^{14} \textrm{Hz}\)). Mais il n'y a pas de discontinuité entre les domaines visibles et l'UV qui sont relatifs tous deux à des transitions concernant les électrons de valence.
En fait comme le montre l'étude des OM (orbitales moléculaires) on doit considérer plusieurs situations en ce qui concerne les liaisons
des liaisons \(\sigma\) à fort recouvrement, très stables et donc éloignées de leurs équivalents antiliants, les liaisons \(\sigma^*\)
des liaisons \(\pi\) résultant d'un recouvrement latéral, plus fragiles et donc plus proches de leurs équivalents antiliants, les liaisons \(\pi^*\)
on peut dans cet inventaire ajouter les paires d'électrons non liants n, qui ne participent pas aux liaisons, mais jouent un rôle important sur la réactivité et la géométrie moléculaire (VSEPR).
Il apparaît donc clairement que les transitions induites par une onde électromagnétique nécessiteront :
plus d'énergie pour les transitions des électrons participant aux liaisons \(\sigma\) (notées \(\sigma\to\sigma^*\)), transitions considérées comme autorisées (même type d'orbitales)
moins d'énergie pour les transitions des électrons participant aux liaisons \(\pi\) (notées \(\pi\to\pi^*\)), transitions également considérées comme autorisées (même type d'orbitales)
moins d'énergie encore pour les transitions des électrons non liants n vers des orbitales anti-liantes \(\pi^*\) (notées \(\textrm n\to\pi^*\)), transitions considérées comme interdites et donc moins probables et moins intenses ; (il existe aussi des transitions \(\textrm n\to\sigma^*\)).
La spectroscopie UV visible est une technique très sensible (beaucoup plus que les suivantes vibrationnelles, rotationnelles et de spin). Elle est notamment utilisée comme principe de détection dans des appareillages traitant de très faibles quantités de produit (détecteur de chromatographie par exemple).
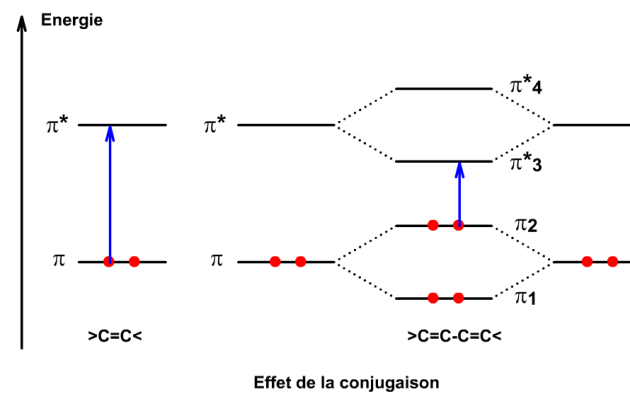
Elle donne des informations GLOBALES sur la molécule, en particulier sur l'état de conjugaison de celle-ci, fort utile en chimie organique. En effet, plus les systèmes insaturés sont conjugués plus les combinaisons des recouvrements des orbitales \(\pi\) conduisent à un rapprochement de l'orbitale \(\pi\) dernière occupée, la “plus haute“ (HOMO : highest occuped molecular orbital) de l'orbitale \(\pi^*\) la “plus basse“ (LUMO : lower inoccuped molecular orbital).
On observe donc avec l'augmentation de la conjugaison une diminution de l'énergie de la transition, ou une augmentation de la longueur d'onde d'absorption que l'on appelle effet batochrome. Parallèlement la probabilité de la transition augmente et donc l'intensité de la bande, c'est l'effet hyperchrome.
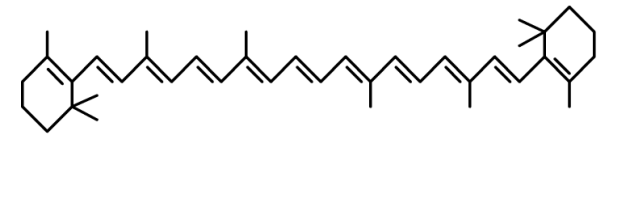
Ainsi le \(\beta\)-carotène avec 11 doubles liaisons conjuguées absorbe dans le domaine du visible à une longueur d'onde de 497 nm, ce qui lui vaut sa couleur .... orange ou carotte !
À l'inverse, une diminution de la conjugaison est accompagnée par les effets inverses (hypsochrome et hypochrome).
Remarque :
Les nombres quantiques concernés par cette spectroscopie UV-visible sont ceux qui sont relatifs aux électrons des couches de valence. L'élargissement des bandes est lié aux états vibrationnels et rotationnels.