Introduction
Rappelons que le modèle de l'oscillateur harmonique permet de déterminer, de manière théorique et approximative, la "fréquence" de l'absorption correspondant à la vibration d'une liaison entre deux atomes. C'est le nombre d'onde associé à la vibration de la liaison :
\(\mathrm{\bar \nu = \frac{1}{2.\pi.c}\sqrt{\frac{k}{\mu}}}\)
avec
k constante de force de la liaison
\(\mu\) masse réduite des deux atomes
c vitesse de la lumière
Le nombre d'onde s'exprime en \(\textrm{cm}^{-1}\).
Ainsi, le nombre d'onde associé à la vibration de la liaison dépend à la fois
de la masse des deux atomes liés (par la masse réduite \(\mu\)),
de la nature de la liaison entre ces deux atomes (par la constante de force \(\textrm k\)).
Pour les molécules organiques, voici les différentes liaisons simples que l'on rencontre et leurs masses réduites \(\mu\):
Liaison | \(\mathrm{\mu ~en ~kg.10^{-26}}\) | Liaison | \(\mathrm{\mu ~en ~kg.10^{-26}}\) |
C-C | 0,99 | C-F | 1,22 |
C-N | 1,07 | C-Cl | 1,49 |
C-O | 1,14 | C-Br | 1,73 |
C-F | 1,22 | C-I | 1,82 |
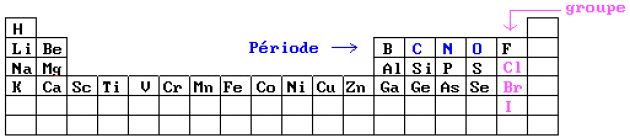
On peut observer que µ varie relativement peu pour les éléments d'une même période et qu'il y a une variation plus forte pour les éléments appartenant à un même groupe :
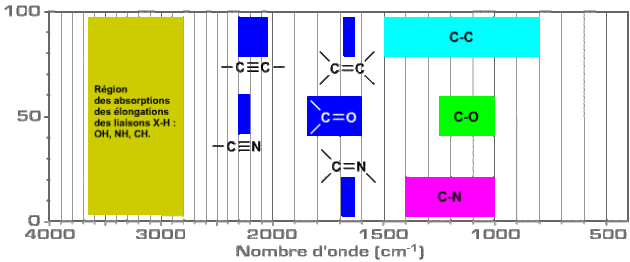
Donc, si on considère les liaisons carbone-carbone, carbone-oxygène ou carbone-azote, la masse réduite variant peu, c'est surtout la variation de la constante de force avec la nature de la liaison (simple - ou double - ou triple liaison) qui va influencer la valeur de la fréquence de la vibration d'élongation.
Par ailleurs, pour des vibrateurs constitués de deux atomes identiques, l'accroissement de la valeur de la constante de force k avec l'ordre de la liaison ( passage de la liaison simple - à la double et à la triple liaison) entraîne une augmentation des valeurs des fréquences d'élongation observées.