Effets stériques
Après les effets inductifs attracteurs d'électrons et les effets de conjugaison qui sont les facteurs principaux de variation de la fréquence de la vibration d'élongation du carbonyle, examinons les effets secondaires : la liaison hydrogène inter ou intra moléculaire, et les effets stériques.
Les liaisons hydrogène.
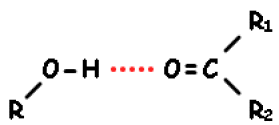
Liaisons hydrogènes inter-moléculaires (détectable par effet de solvant) cette liaison peut s'établir avec un solvant hydroxylé tel que le méthanol.
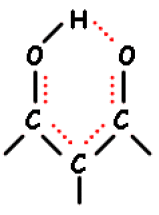
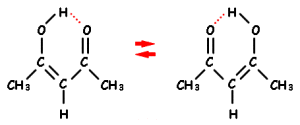
Liaisons hydrogènes intra-moléculaires cette liaison se produit dans le cas de ß-dicétones.
Retenez que les liaisons hydrogènes inter-moléculaires sont détectables par leur dépendance à leur concentration dans le solvant inerte alors que les liaisons intra-moléculaires ne subissent pas cet effet de solvant. Ces liaisons hydrogènes ont pour effet :
de diminuer le caractère \(\pi\) de la liaison double
d'augmenter la longueur de la liaison
de diminuer la constante de force, donc
de DIMINUER la fréquence de vibration de la double liaison >\(\textrm{C=O }\)
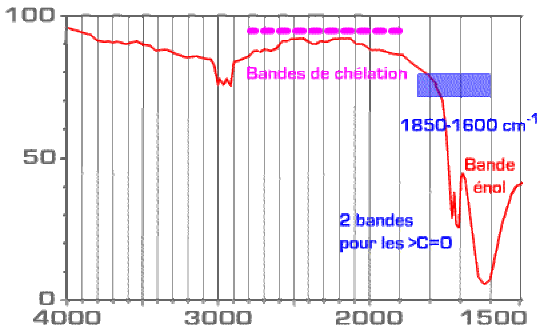
On observe une double absorption pour le >\(\textrm{C=O}\) (carbonyle libre et carbonyle lié), tandis que la forme énol apparaît vers 1680 cm-1.
Dans le cas présent de l'acétylacétone, la bande de chélation est relativement faible.
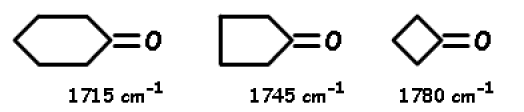
Les facteurs stériques.
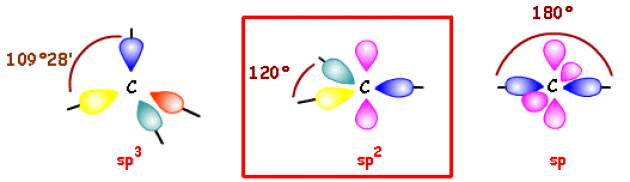
Vous avez appris que les liaisons simples s'établissent avec les orbitales hybrides de l'atome de carbone :
Dans le cas du carbonyle >\(\textrm{C=O}\), on est en présence d'une hybridation \(\mathrm{sp}^2\).
Pour les cétones cycliques, dans le cas des cycles inférieurs à 6 chaînons, on observe une diminution de l'angle de 120°. Cette contrainte stérique se manifeste par une augmentation de la fréquence de vibration de l'élongation >\(\textrm{C=O}\) :