Introduction
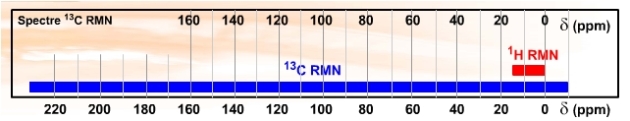
Après une pratique suffisante de la RMN du proton, lorsque l'on découvre la RMN du \(\textrm{}^{13}\textrm C\), on ne peut qu'être étonné de l'étendu du domaine des déplacements chimiques.
Alors que le domaine de résonance de la RMN du proton est de 15 ppm environ (pour les molécules organiques), les déplacements chimiques du \(\textrm{}^{13}\textrm C\) couvrent une échelle nettement plus importante d'environ 250 ppm dans le domaine de la chimie organique et qui peut atteindre 600 ppm pour l'ensemble des aspects chimiques du carbone.
Note : Ceci n'est pas une spécificité du carbone, le fluor \(\textrm{}^{19}\textrm F\) et le phosphore \(\textrm{}^{33}\textrm P\) ont des plages de déplacements chimiques encore plus larges.
En fait, c'est l'étroitesse de la plage du proton qui est un cas particulier. Pour une très grande part de sa chimie, l'hydrogène est simplement lié à un autre atome, par une liaison classique constituée de deux électrons. Les effets essentiels seront ceux de proximité (prédominance de l'effet ) affectant la densité électronique et donc l'écran. Les effets d'anisotropie, à l'origine de la séparation des hydrogènes éthyléniques et aromatiques de ceux des alcanes (glissement déblindant de 3 à 5 ppm), jouent aussi un rôle important.
Avec des atomes plus riches en électrons, comme le carbone, les dépendances du déplacement chimique vont être plus marquées par l'état de ses électrons. Cela se traduit par l'existence de domaine de déplacements chimiques spécifiques aux différentes hybridations du carbone. Mais attention, ces plages ne sont pas univoques et nous verrons plus loin comment tel ou tel type de carbone peut se trouver dans une plage plus particulièrement « réservée » à un autre type de carbone.
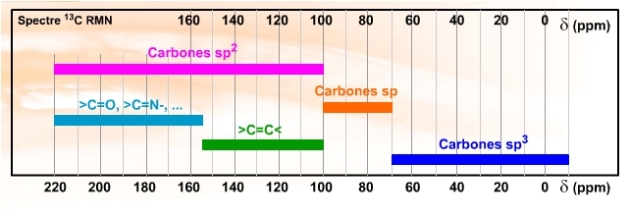
Mis à part de tels comportements, 4 plages assez bien vérifiées « statistiquement » sont rencontrées :
de -20 à 70 ppm les carbones \(\textrm{sp}^3\)
de 70 à 100 ppm les carbones \(\textrm{sp}\) (triple liaison carbone-carbone)
de 100 à 220 ppm les carbones \(\textrm{sp}^2\), séparable en deux zones :
100 à 155 ppm les doubles liaisons carbone-carbone
155 à 220 ppm les doubles liaisons carbone-oxygène ou autre hétéroatome
Une approche des déplacements chimiques consiste à décomposer les contributions à l'écran du noyau étudié selon plusieurs effets :
\(\sigma^{\textrm d}\) correspond à la précession du nuage électronique ; c'est un effet blindant diamagnétique
\(\sigma^{\textrm p}\) correspond à la contribution des orbitales p (cette contribution n'existe pas pour les orbitales s) ; c'est un effet paramagnétique, déblindant pour l'hybridation \(\textrm{sp}^2\) (1 orbitale p non hybridée) plus complexe pour les carbones hybridé \(\textrm{sp}\) (2 orbitales p non hybridée mais aussi perpendiculaires et donc aux effets résultants très amortis)
\(\sigma^{\textrm e}\) correspond aux effets de champ électrique intra ou intermoléculaire (association de dipôles qui déforme le nuage électronique en le polarisant)
\(\sigma^{\textrm a}\) correspond à l'anisotropie de la précession de groupe d'électrons ; très présent en \(\textrm{}^1\textrm H\) RMN cet effet est moins performant en \(\textrm{}^{13}\textrm C\) RMN en raison de l'étendue des échelles de déplacements chimiques.
Pour l'essentiel, ce sont \(\sigma^{\textrm d}\) et \(\sigma^{\textrm p}\) qui contribuent aux déplacements chimiques, et sont à l'origine des grandes zones de déplacements chimiques présentées ci-dessus.
Par ailleurs, il faut noter que les déplacements chimique sont sensibles à la proximité d'espèce paramagnétiques (radicaux, sels de terre rare, ....) et également au pH de la solution notamment pour des carbones fonctionnalisés.