Les effets alpha
Les effets alpha Comme pour la RMN du proton, on peut considérer qu'il y a une forte influence des groupements voisins notamment en . Dans ces conditions, l'électronégativité joue un rôle prévisible, mais qui va ici dépendre de l'hybridation du carbone et de la masse (!) de l'atome branché sur le carbone C.
Carbone Csp3
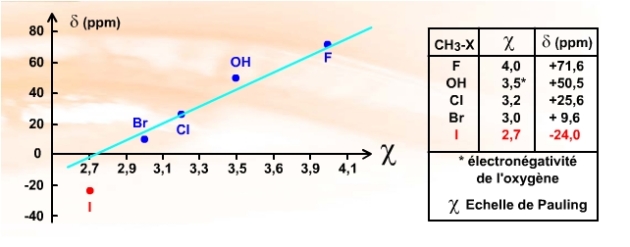
On retrouve pour les carbones \(\textrm{sp}^3\) un déblindage d'autant plus important que l'atome fixé au carbone est électronégatif :
Conséquence de l'électronégativité, la liaison \(\textrm{C-X}\) étant polarisée, la densité d'électron diminue sur le carbone. Cela se traduit par un déblindage.
Nous avions également observé cet effet de déblingade dans le cas de la \(\textrm{}^1\textrm H\) RMN. Mais à la différence du proton qui est séparé de\( \textrm X\) par deux liaisons (\(\textrm{H-C-X}\)), le carbone est directement lié à \(\textrm X\) et va donc aussi être encore plus sensible au nuage électronique de ce dernier.
On observe bien ce déblindage dans la série \(\textrm{CH}_3\textrm{-F}\), \(\textrm{CH}_3\textrm{-OH}\), \(\textrm{CH}_3\textrm{-Cl}\), \(\textrm{CH}_3\textrm{-Br}\)... Par contre, pour l'iode et \(\textrm{CH}_3\textrm{-I}\), on observe un déplacement chimique anormalement bas (le signal résonne en-dessous de la valeur du TMS : -24 ppm)... Si l'iode polarise certes la liaison, sa taille masque le noyau du carbone... c'est ce que l'on appelle un effet d'atome lourd et c'est alors l'effet dominant qui conduit à un déplacement chimique négatif.
Remarque :
A ce propos, le zéro de l'échelle des \(\delta\) est toujours défini par le signal du TMS (Tétra Méthyle Silane \(\textrm{SI(CH}_3\textrm)_4\), composé que nous avons rencontré en \(\textrm{}^1\textrm H\) RMN... Cela est pratique pour la préparation de solutions destinées à la RMN du \(\textrm{}^1\textrm H\) et du \(\textrm{}^{13}\textrm C\), et aussi justifié par les mêmes raisons que celle évoquées pour la RMN du proton. Cependant le signal du TMS n'est plus ici une sorte de «butoir à champ fort» (pour les composés organiques classiques), l'effet d'atome lourd déplaçant les déplacements chimiques \(\delta\) sous le signal du TMS comme on vient de le voir par exemple pour \(\textrm{CH}_3\textrm{-I}\) ...
Carbone Csp2
En matière d'effet de proximité, la situation pour les carbones \(\textrm{sp}^2\) est nettement plus complexe :
si l'hétéroatome en \(\alpha\) est directement et doublement lié à un carbone \(\textrm{sp}^2\), la double liaison s'en trouve très polarisée (à l'origine des forts déblindages du \(\textrm{C=O}\) des cétones et des aldéhydes entre 170 et 220 ppm)
si l'hétéroatome en \(\alpha\) est directement (et simplement) lié à un carbone \(\textrm{sp}^2\), \(\textrm{X-C=(C)}\), la simple liaison s'en trouve très polarisée (par exemple à l'origine des forts déblindages pour des carbones substitués par l'oxygène ou l'azote dans les cycles aromatiques)
si l'hétéroatome est indirectement (en \(\beta\)) et simplement lié à un carbone \(\textrm{sp}^2\) intermédiaire (via la double liaison), cas de \(\textrm{X-(C)=C}\), l'effet dominant sera un blindage, l'hétéroatome participant à la conjugaison en « prêtant » son doublet libre.
En résumé, les effets d'un groupe électronégatif et donneur d'électrons par conjugaison sont :
déblindants en \(\alpha\) pour les carbones quelques soient leurs hybridations (excepté l'effet d'atome lourd),
blindants en\( \beta\) pour les carbones \(\textrm{sp}^2\)
Additivité
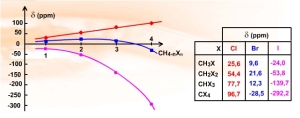
Concernant l'additivité des effets de substitution, la situation se complique également. en RMN du \(\textrm{}^{13}\textrm C\).
Alors que la progression des déplacements chimiques des \(\textrm{CH}_{4-\textrm n}\textrm X_4\) est quasiment linéaire pour les composés chlorés, elle s'inverse (lourdement) pour les composés iodés. Quant aux composés bromés, ils ont un comportement intermédiaire, le poids du « masquage » du noyau augmentant avec le nombre d'atome d'halogène.