Règle de remplissage
Pour déterminer la configuration électronique des éléments, on utilise un critère énergétique simple : l'état fondamental (de plus basse énergie) est obtenu en peuplant les orbitales de plus basse énergie. On remplit donc les sous-couches par le bas du spectre énergétique des orbitales. L'ordre des orbitales est donné par le diagramme de Latter qui reporte les énergies des orbitales en fonction du numéro atomique \(\textrm Z\).
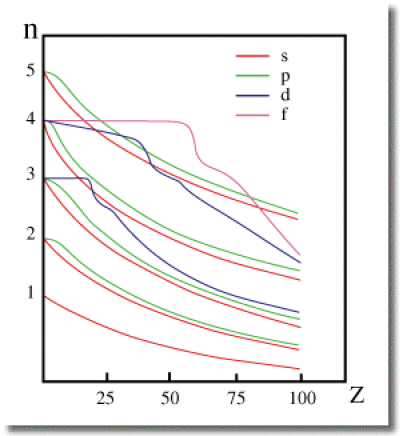
Diagramme de Latter : énergies des orbitales en fonction du numéro atomique.
On tient évidemment compte de la règle de Pauli : pas plus de deux électrons par orbitale et dans ce cas, les spins doivent être appariés.
Pour certains éléments, on observe sur le diagramme de Latter que certaines sous-couches voient leur énergie devenir supérieure à celle d'une sous-couche de la couche supérieure.
Il en est ainsi de la sous-couche \(3\textrm d\) qui passe au dessus de la sous-couche \(4\textrm s\) pour le potassium \(\textrm K\) (\(Z=19\)) et le calcium \(\textrm{Ca}\) (\(Z=20\)). Leur sous-couche \(4\textrm s\) est donc remplie avant la \(3\textrm d\). Cette inversion est liée à la partie interne de l'orbitale \(4\textrm s\) qui conduit à une stabilisation plus importante des électrons \(4\textrm s\) par l'attraction coulombienne du noyau.
Pour les éléments de la première série de transition, du scandium au zinc, l'ordre habituel est rétabli mais l'orbitale \(4\textrm s\) reste doublement occupée. Ils s'écartent de la règle basée sur les énergies des orbitales. De manière générale, les métaux de transition d'une période \(n\) voient leur sous-couche externe \(ns\) se remplir avant la sous-couche \((n-1).\textrm d\).
La règle de remplissage dite "règle de Klechkowski" permet de retrouver facilement l'ordre de remplissage des orbitales à l'aide du schéma de cases quantiques. On remplit les sous-couches en diagonale comme illustré ci-dessous.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.