Longueur de liaison
La matière est constituée de particules mobiles et une liaison chimique doit être vue comme un assemblage dynamique. Tout comme les électrons liés à un atomes sont animés d'un mouvement autour du noyau, deux atomes liés ne restent pas à distance fixe : la longueur de la liaison chimique varie dans des proportions non négligeables. Dans une vision mécanique et classique, on peut l'assimiler à un ressort dont la longueur oscille au cours du temps. On dit qu'elle est animée d'un mouvement de vibration.
Pour comprendre cet aspect dynamique, on peut adopter un point de vue classique dans lequel on assimile les deux atomes à un ressort.
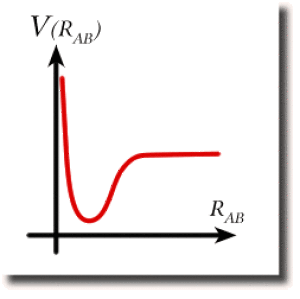
L'énergie totale de ce ressort est la somme de l'énergie cinétique et de l'énergie potentielle. Elle est toujours supérieure à l'énergie potentielle. Cette dernière traduit les interactions entre les deux atomes. Si la molécule existe dans un état stable, c'est que cette énergie potentielle, représentée en fonction de la distance interatomique, présente un puits schématisé ci-contre.
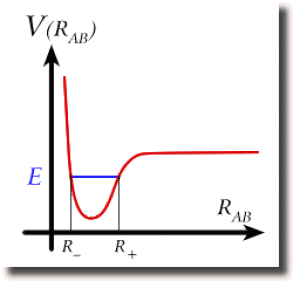
Lorsque l'énergie cinétique n'est pas trop élevée, l'énergie totale \(\textrm E\) n'atteint pas le bord du puits : elle n'est pas assez importante pour permettre à la molécule de se dissocier. La longueur de liaison est alors confinée, par le puits d'énergie potentielle, entre deux bornes \(\textrm R_+\) et \(\textrm R_-\), de part et d'autre du fond du puits, qui donnent l'amplitude de la vibration moléculaire à cette énergie.
La longueur de la liaison correspond au minimum de l'énergie potentielle. On l'appelle aussi distance d'équilibre de la liaison.