Variation des angles géométriques (2)
Durée : 8 mn
Note maximale : 4
Question
Dans les molécules\(\textrm{CF}_{2}\textrm{O}\)et\(\textrm{CH}_{2}\textrm{O}\), l'angle\(\textrm{OCH}\)ou\(\textrm{OCF}\)est-il plus ou moins grand que 120º ?
Justifier.
Comparer les angles de liaison des molécules\(\textrm{CF}_{2}\textrm{O}\)et\(\textrm{CH}_{2}\textrm{O}\).
Justifier les différences prévisibles.
Solution
Les schémas de Lewis des molécules sont donnés ci-dessous. Dans les deux cas, le carbone est de type\(\textrm{AX}_{3}\): la molécule est plane et s'inscrit dans un triangle.
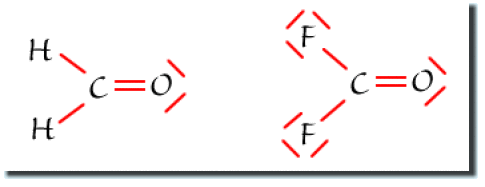
Dans ces deux molécules, la double liaison\(\textrm{C}=\textrm{O}\) est plus répulsive qu'une simple liaison. On s'attend donc à un angle\(\textrm{OCH}\)et\(\textrm{OCF}\)plus grand que 120º.
Dans\(\textrm{CF}_{2}\textrm{O}\), les fluors sont beaucoup plus électronégatifs que l'hydrogène. Les liaisons\(\textrm{C-F}\)sont alors très polarisées vers les fluors et de ce fait plus éloignées les unes des autres. Leur répulsion est moindre et on s'attend à un angle\(\textrm{FCF}\)plus faible que l'angle\(\textrm{HCH}\)(108º contre 118º respectivement).