La molécule BrF5
Durée : 10 mn
Note maximale : 5
Question
Le moment dipolaire associé à une liaison\(\textrm{Br-F}\)vaut 1,3 Debye.
La molécule\(\textrm{BrF}_{5}\)possède-t-elle un moment dipolaire permanent ?
Faire un schéma explicatif et déterminer la valeur éventuelle du moment moléculaire.
Solution
Le schéma de Lewis de la molécule\(\textrm{BrF}_{5}\)est donné ci-dessous. On n'a pas représenté les paires non liantes des fluors. Le brome est de type\(\textrm{AX}_{5}\textrm{E}\). Sa figure de répulsion est un octaèdre et la molécule est une pyramide à base carrée.

Le brome se place au centre de la base. L'électronégativité supérieure de fluor conduit à polariser le nuage électronique vers le sommet de la pyramide. Il apparaît donc un moment dipolaire dirigé, indiqué sur la figure ci-dessous.
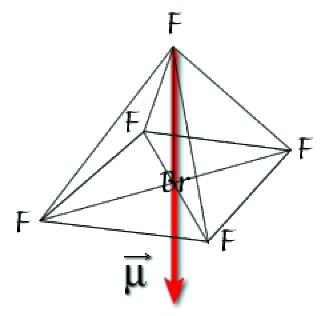
Les moments des liaisons Br-F se compensent sur la base. La résultante du moment dipolaire est donc dirigée du fluor en position axiale vers le brome (convention physique) et vaut 1,3 Debye.