Etats liés et états dissociatifs
La stabilité de la molécule dépend de la forme qu'affecte l'énergie potentielle moléculaire. Il n'est pas nécessaire de recourir à une description quantique pour comprendre l'importance de l'allure de cette énergie potentielle et on peut utiliser à la place quelques notions simple de mécanique classique. On distingue deux cas de figure :
L'énergie potentielle moléculaire présente un puits comme représenté sur la figure ci-contre. En cliquant sur l'image, une animation démontrera pourquoi dans un état d'énergie suffisamment basse, les deux atomes se trouvent liés l'un à l'autre "prisonniers" du puits. L'état électronique de la molécule est un état liant.
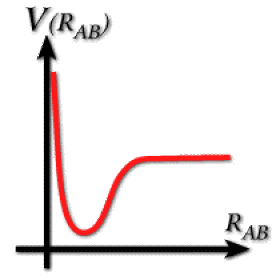
État liant
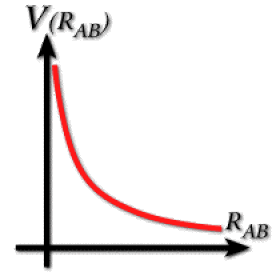
État dissociatif
Si l'énergie potentielle moléculaire ne présente pas de puits l'état électronique n'est pas stable et les deux atomes ne peuvent que se séparer. L'état électronique de la molécule est un état dissociatif.
Chaque état électronique d'une molécule est associé à une énergie potentielle caractéristique.
A titre d'exemple on a représenté ci-contre les courbes d'énergie potentielle des quatre premiers états de \(\textrm H_2\).
Le zéro sur l'échelle d'énergie correspond aux deux atomes séparés.
L'état fondamental (courbe inférieure bleue) est liant ; les états excités sont liants ou dissociatifs.
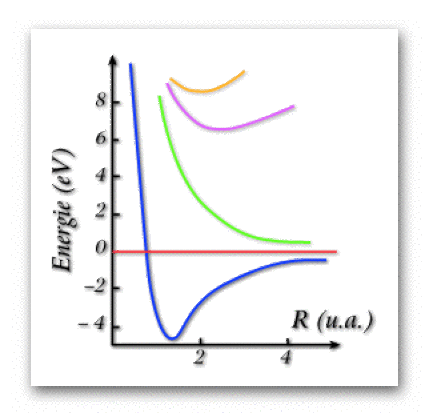
Courbes d'énergie potentielle de la molécule \(\mathrm{H_2}\)