L'énergie potentielle moléculaire
On a représenté ci-dessous les courbes d'énergie potentielle moléculaire des deux premiers états obtenues suivant le calcul de Heitler et London, après avoir rajouté la répulsion nucléaire aux énergies électroniques. Le zéro de l'échelle énergétique correspond à deux atomes d'hydrogène séparés.
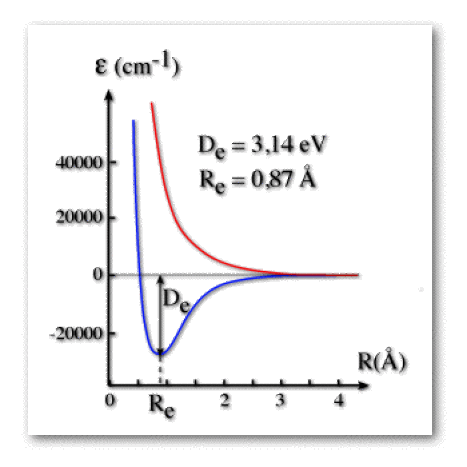
L'état fondamental \(\Psi_1\) est un état liant. Le fond du puits donne une distance d'équilibre de la liaison \(\textrm H-\textrm H\) de 0,87 Å, plus longue que la valeur expérimentale 0,74 Å. La profondeur du puits \(D_\textrm e\) vaut 3,14 eV inférieure à la valeur expérimentale 4,74 eV. Le calcul donne une allure qualitativement correcte puisqu'il reproduit à la fois l'existence du puits et l'asymptote horizontale de la dissociation. En ce sens, le modèle des Liaisons de Valence est plus performant que le modèle des Orbitales Moléculaires.
Le modèle décrit aussi correctement le caractère dissociatif du second état.
Si on essaie d'analyser les défauts du modèle, on peut en identifier deux :
la fonction de Heitler et London impose aux deux électrons d'être portés par deux orbitales distinctes. Parce qu'elle ne décrit qu'une seule configuration covalente, elle ne permet pas qu'ils puissent se trouver du même coté de la liaison.
les orbitales utilisées sont celles des atomes isolés. Il est cependant légitime qu'elles s'adaptent à l'existence d'interactions entre les atomes.