Hybridation interatomique : illustrations
Le degré d'hybridation interatomique évolue avec la distance internucléaire :
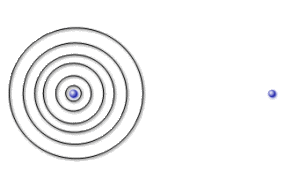
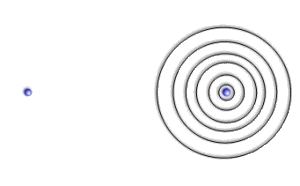
Les deux atomes sont suffisamment éloignés pour que leur interaction soit négligeable. L'orbitale atomique ressemble alors très fortement à l'orbitale \(1\textrm s\) d'un atome d'hydrogène isolé (\(\mu\gg\lambda\) ).
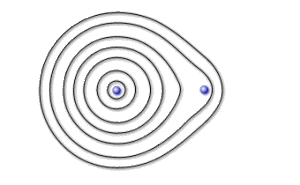
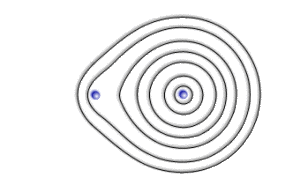
Lorsque les deux atomes sont situés à la distance d'équilibre de la liaison, les orbitales reflètent l'interaction. La stabilisation énergétique étant liée à l'énergie d'échange qui dépend elle même du recouvrement, on observe que la forme optimale des orbitales correspond à une déformation qui tend à maximiser ce recouvrement ( \(\lambda\) n'est plus négligeable par rapport à \(\mu\) ).
En considérant des combinaisons linéaires plus riches (inclusion d'orbitales \(2\textrm s\), \(2\textrm p\), ...), on arrive à un excellent accord avec l'expérience : 0.015 Å d'écart à la valeur expérimentale de la distance d'équilibre et près de 90% de l'énergie de liaison.