Ordre de liaison
Partie
Question
Construire dans l'approximation LCAO le diagramme de corrélation des molécules \(\mathrm{H_2^+, ~H_2, ~He_2^+ ~et~ He_2}.\)
Déterminer l'ordre de stabilité de ces espèces.
Aide simple
On donne l'expression de l'ordre de liaison pour une diatomique :
\(\mathrm{D=\frac{nb~d'electrons~liants~-~nb~d'electrons~antiliants}{2}}\)
Aide méthodologique
On doit compter les électrons de valence de chaque espèce pour effectuer le remplissage des orbitales moléculaires.
Solution détaillée
Le diagramme de corrélation général est représenté ci-dessous. Pour l'hydrogène et l'hélium, on se contente de mélanger les orbitales 1s des deux atomes.
On construit alors deux combinaisons : la liante \(\sigma_{\mathrm{g}}\) et l'antiliante \(\sigma_{\mathrm{u}}\).
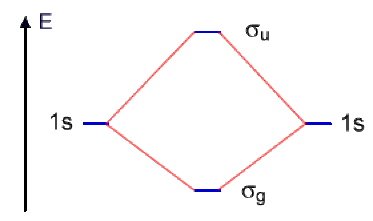
On peuple les deux OM avec les électrons disponibles :
\(\mathrm{H_2^+}\) | \(\mathrm{H_2}\) | \(\mathrm{He_2^+}\) | \(\mathrm{He_2}\) | |
Nombre d'électron(s) | 1 | 2 | 3 | 4 |
Les diagrammes de corrélation sont représentés ci-dessous
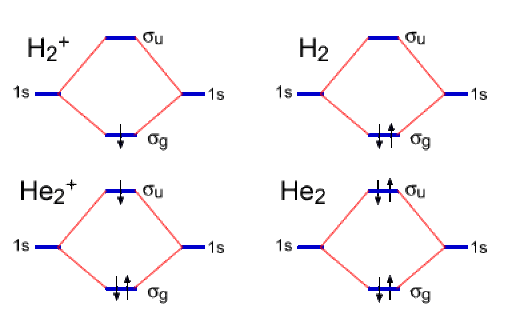
Les ordres de liaison sont définis par :
\(\mathrm{D=\frac{nb~d'electrons~liants~-~nb~d'electrons~antiliants}{2}}\)
\(\mathrm{H_2^+}\) | \(\mathrm{H_2}\) | \(\mathrm{He_2^+}\) | \(\mathrm{He_2}\) | |
Ordre de liaison | \(\frac{1}{2}\) | 1 | \(\frac{1}{2}\) | 0 |
On trouve dans l'ordre croissant des stabilités :
\(\mathrm{He_2, (H_2^+, He_2^+)~ et~ H_2}.\)
Le dihydrogène est la molécule la plus stable ; elle contient une liaison covalente à deux électrons. Les deux ions moléculaires contiennent une demi liaison covalente, soit une liaison à un électron. Il n'y a pas de liaison covalente dans \(\mathrm{He_2}\). La liaison dans cette dernière espèce est assurée par des forces beaucoup plus faibles, de type Van der Waals.