Diagramme de corrélation de la molécule LiH
Partie
Question
Dans l'approximation LCAO, établir le diagramme de corrélation de la molécule LiH.
On disposera les deux atomes sur l'axe 0z.
On donne les énergies de première ionisation de Li et H :
\(\mathrm{I_1(Li) = 5,4~eV}\)
\(\mathrm{I_1(H) = 13,6 ~eV}.\)
Aide simple
L'énergie de première ionisation permet de placer relativement les niveaux d'énergie des orbitales atomiques. Elle traduit l'électronégativité relative des atomes.
On doit effectuer le mélange de 3 orbitales atomiques pour former les OM de symétrie \(\sigma\). La première combinaison conduit à des effets liants quelle que soit la paire d'OA de Li et H. La dernière combinaison montre des effets antiliants uniquement. Dans la seconde combinaison, les OA de plus basse énergie des deux atomes conduisent à un effet antiliant.
Aide méthodologique
Après identification des orbitales atomiques de valence, on effectue les combinaisons linéaires des OA compatibles en terme de symétrie.
Une méthode graphique de représentation des mélanges d'OA permet de classer les OM obtenues dans l'ordre des énergies, en comparant les effets liants et antiliants.
Aide à la lecture
La construction d'un diagramme de corrélation suppose de positionner les niveaux d'énergie des orbitales atomiques et de les connecter aux niveaux des orbitales moléculaires qu'elles composent.
Solution détaillée
La position des orbitales \(\mathrm{2s_{Li}}\) et \(\mathrm{1s_H}\) est donnée par les énergies de première ionisation.
\(\mathrm{E(2s_{Li}) = -5,4 ~eV}\)
\(\mathrm{E(1s_H) = -13,6 ~eV}\)
Les orbitales \(\mathrm{2p_x}\) et \(\mathrm{2p_y}\) de Li ne se mélangent pas à l'orbitale 1s de l'hydrogène. Elles sont non liantes et se positionnent au même niveau au centre du diagramme.
Les orbitales 2s et \(\mathrm{2p_z}\) du lithium se mélangent à l'orbitale 1s de H pour former trois combinaisons.
La première combinaison, de plus basse énergie, est totalement liante. Les signes des orbitales atomiques sont tels que tous les recouvrements sur la liaison se font entre lobes de même signe. En raison de la grande différence d'énergie entre les OA du lithium et de H, on peut considérer que le poids de la 1s de l'hydrogène est très important dans cette OM.
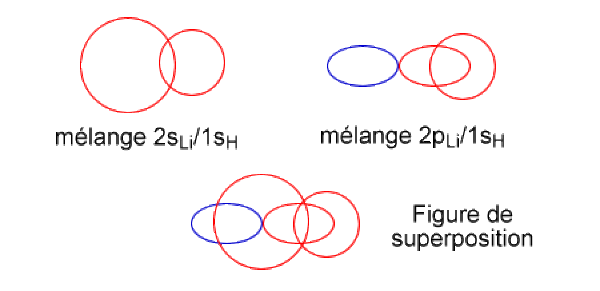
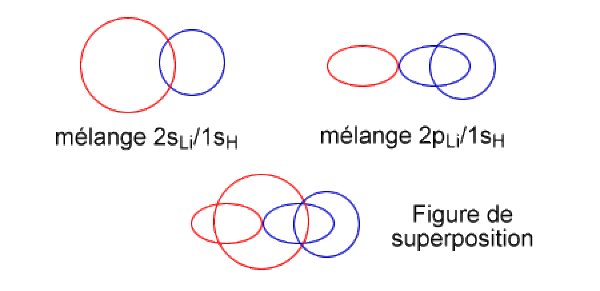
La troisième combinaison, de plus haute énergie est totalement antiliante. Les signes des orbitales atomiques sont tels que tous les recouvrements sur la liaison se font entre lobes de signes opposés. En raison de la grande différence d'énergie entre les OA du lithium et de H, on peut considérer que le poids de la 1s de l'hydrogène est faible dans cette OM.
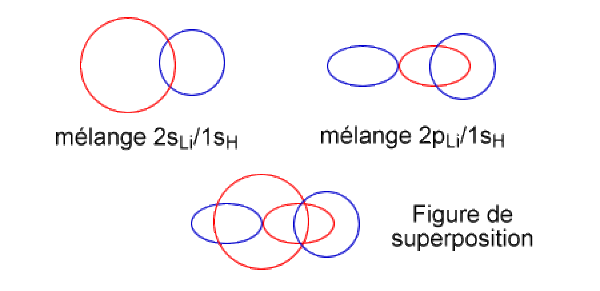
Dans la seconde combinaison, d'énergie intermédiaire, les signes des orbitales \(2\mathrm{s_{Li}}\) et\( 1\mathrm{s_H}\) sont opposés : l'effet de recouvrement est antiliant. Le signe de l'orbitale \(2\mathrm{p_z}\) est tel qu'il donne lieu à un effet liant. Cette seconde OM est de nature non liante, par compensation des effets liants et antiliants.
Le diagramme de corrélation est donné ci-dessous.
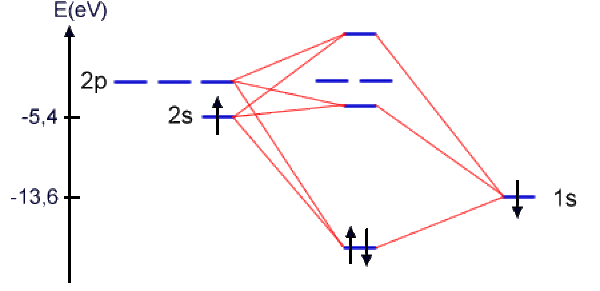
On ne peut prédire exactement la position du second niveau par rapport aux non liantes \(2\mathrm{p_{Li}}\). Cette position dépend du niveau d'approximation dans les calculs d'énergie d'interaction entre orbitales atomiques. Si on considère qu'en raison de la très grande différence d'énergie entre les OA du lithium et de l'hydrogène, cette combinaison contient surtout les OA du lithium, alors on peut assimiler cette OM à un mélange des OA 2s et 2p dont l'énergie est située entre les niveaux 2s et 2p du lithium, légèrement en dessous des OA 2p non liantes.