Définition
La liaison de Van der Waals regroupe l'ensemble des liaisons faibles non directionnelles entre atomes ou molécules neutres.
Elle résulte d'interactions attractives multipolaires, d'induction et de dispersion qui sont contrebalancées à courte distance par les forces répulsives.
La description quantitative de l'apport de chaque type d'interaction est en pratique très difficile à établir. On utilise souvent une expression empirique de l'énergie potentielle d'interaction qui regroupe les contributions attractives et répulsives. Pour des paires d'atomes, on utilise souvent est l'expression de Lennard-Jones :
\(\mathbf{U=4.\epsilon.\bigg[\Big(\frac{\sigma}{R}\Big)^{12}-\Big(\frac{\sigma}{R}\Big)^6\bigg]}\)
Le premier terme est répulsif, le second attractif. La courbe d'énergie potentielle d'interaction entre deux atomes d'argon est donnée ci-dessous. On a aussi repésenté les deux contributions de Lennard-Jones :
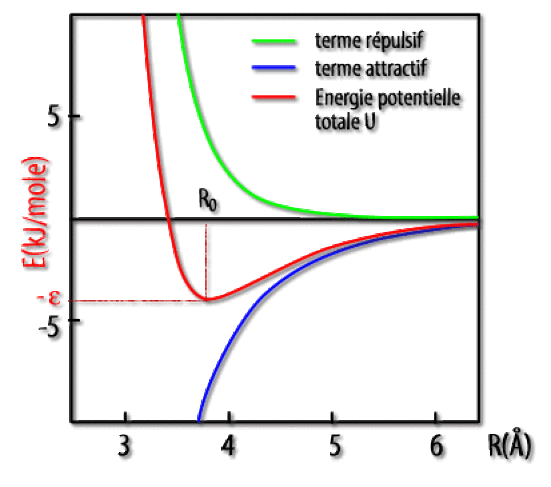
Le zéro de l'énergie correspond aux deux atomes séparés à l'infini l'un de l'autre. Le minimum \(\mathrm{U_\textrm{min}}\) de \(\textrm U\) est atteint pour une distance d'équilibre \(\textrm R_0\) :
\(\mathbf{U_\textrm{min}=-\epsilon R_0=2^{1/6}.\sigma}\)
Pour des paires de molécules, il faut faire appel à des expressions plus compliquées.