Glycoconjugués
Des oligosaccharides se lient à des protéines ou à des lipides pour former des glycoconjugués.
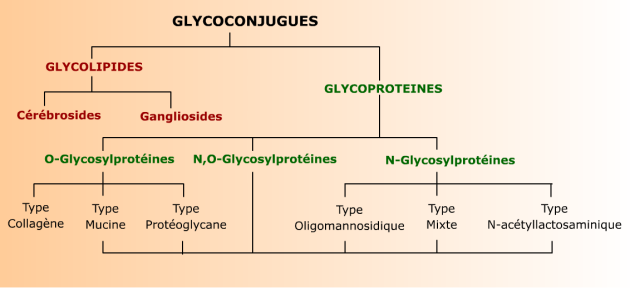
Le terme glycoconjugué définit des produits d'association covalente de glucides, qui prennent alors le nom de glycanes ou glycannes (les deux orthographes sont permises), soit avec une protéine, soit avec un lipide. On parle alors de glycoprotéine, ou de glycolipide. Dans la majorité des cas, les glycanes sont des oligosaccharides liés aux protéines ou aux lipides par leur extrémité réductrice.
Les protéoglycanes se distinguent des autres glycoconjugués par le fait que leurs glycanes ne sont pas des oligosaccharides, mais des polysaccharides pouvant atteindre une centaine de résidus. Pour cette raison, ils sont détaillés plus loin, avec les polysaccharides qu'ils contiennent (voir Glycosaminoglycanes). Cette page est plus particulièrement consacrées aux glycanes oligosaccharidiques, impliqués dans la reconnaissance de cellules, de microorganismes et de molécules.
Complément :
Seuls les types les plus représentatifs sont indiqués. Les structures des glycolipides et des glycoprotéines sont décrites plus en détail dans les chapitres consacrés aux lipides et aux protéines.
Les glycanes des glycoconjugués contiennent principalement des hexoses (D-glucose, D-galactose, D-mannose) et leurs dérivés naturels, ose aminés (voir Oses aminés) et acides uroniques (voir Uronates), un ose désoxy : le fucose (voir Oses désoxy) et deux pentoses (L-arabinose et D-xylose). Ils contiennent aussi des acides sialiques (voir Acides sialiques) dont le plus commun est l'acide N-acétyl neuraminique. Les résidus y sont parfois sous forme d'esters, phosphates ou sulfates (voir Ethers et esters).
On connait actuellement des milliers de structures de glycanes. Leur étude comparée permet de les classer par familles, à l'intérieur desquelles les structures sont semblables ou très voisines, et présentent des enchaînements oligosaccharidiques communs quelle que soit l'origine des glycoconjugués : virale, bactérienne, végétale ou animale.
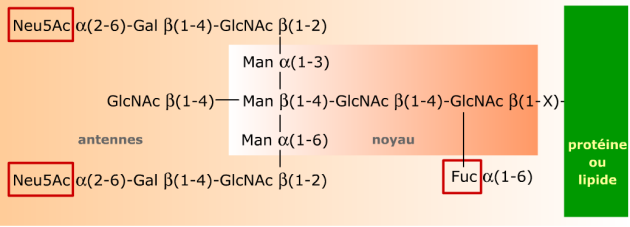
Les glycanes sont liées à la protéine ou au lipide par une liaison O- ou N- glycosidique. Dans chaque structure on peut distinguer un noyau invariant relativement rigide, que l'on retrouve dans tous les glycanes d'une même famille et qui sert de point d'ancrage entre le sucre et l'autre molécule. Ce noyau peut apparaître seul, ou substitué par plusieurs (jusqu'à 6) antennes qui sont des chaînes d'oligosaccharides flexibles et de composition variable en oses. Ces antennes sont principalement responsables de la spécificité biologique des glycanes. L'ensemble peut également être substitué par des résidus simples, en général de L-fucose et/ou d'acide sialique (Neu5Ac).
Complément : Observer
Observer les noyaux des structures de O- et N-glycanes
Une animation interactive permet de faire défiler les différentes structures sur la même séquence protéique.
Complément :
Il s'agit ici d'un glycane tri-antenné du type N-acétyllactosamine, reconnaissable par la présence de l'unité N-acétyllactose Gal-β(1-4)-GlcNAc dans ses antennes. Les résidus encadrés (Neu5Ac et Fuc) sont des substituants fréquents des antennes et du noyau des glycanes dans les glycoprotéines.
Complément : Observer
Observer la structure tridimensionnelle d'un glycane
Un modèle moléculaire peut être manipulé.
Les glycoconjugués sont essentiels aux processus de reconnaissance et de signalisation.
Les innombrables combinaisons permises par les différents oses, la diversité de leurs enchaînements ainsi que leur anomérie peuvent être comparées aux mots d'un langage, et justifient le rôle des glycoconjugués comme signaux de reconnaissance dans de nombreux processus physiologiques et pathologiques. Il existe des protéines capables de lire les mots de ce langage structural. Elles appartiennent à des classes très diverses : enzymes (glycosyltransférases, glycosidases), anticorps, toxines, lectines (aussi appelées agglutinines, adressines, adhésines, sélectines etc...) qui existent aussi bien sous forme soluble circulante qu'intégrées aux membranes cellulaires.
Les fonctions des glycoconjugués relèvent plus du programme de Biologie cellulaire que de celui de la Biochimie. Toutefois, quelques points de repère dans la mise en évidence de ces fonctions permettent de mieux comprendre l'évolution remarquable des idées au sujet de ces molécules.
Complément : Les glycoconjugués comme signaux de reconnaissance
Les structures glycaniques présentes à la surface des cellules des mammifères et à la périphérie des microorganismes constituent des signaux spécifiquement reconnus par des protéines membranaires (récepteurs) d'autres cellules, ou par des molécules isolées, en général des protéines : enzymes, anticorps, lectines, etc...
Cette signalisation cellulaire ou moléculaire intervient dans des processus biologiques très variés. Les paragraphes qui suivent en dressent une liste non exhaustive.
Déterminants antigéniques
Les groupes sanguins sont déterminés par des glycanes de la surface des cellules sanguines (hématies, leucocytes, plaquettes) et de cellules épithéliales. Ces glycanes sont reconnus et fixés par des anticorps spécifiques : les individus A ou O possèdent des anticorps anti-B, et les individus B ou O possèdent des anticorps anti-A. En se fixant aux glycanes des surfaces cellulaires, les anticorps provoquent l'agglutination des cellules sanguines. Il n'y a pas ou très peu d'anticorps anti-O car le motif glycanique du groupe O sert de base à la construction des motifs A et B, et est donc présent chez tous les individus. L'organisme ne faisant normalement pas d'anticorps contre ses propres déterminants, le groupe O est dit groupe universel.
Infections et défenses
Les agents infectieux comme les bactéries, les virus et les levures utilisent les glycanes des cellules de l'hôte pour se fixer et pénétrer dans les tissus. La reconnaissance de signaux particuliers présents sur certaines cellules de l'hôte explique les spécificités cellulaire, tissulaire et d'espèce des infections. Une lectine portée par l'enveloppe du virus de la grippe, par exemple, reconnaît des N-glycanes de type N-acétyllactosaminique. Les bactéries pathogènes portent sur leurs poils des adressines ou adhésines (lectines) qui reconnaissent les glycanes des surfaces épithéliales.
En réponse, l'organisme infecté reconnaît les glycanes de surface de l'agent pathogène (coque des bactéries, enveloppe des virus), qui sont la cible de protéines solubles et des récepteurs des membranes des leucocytes. L'agent pathogène peut d'abord être enduit de ces molécules solubles (opsonisation). Il est ensuite attaqué par les cellules chargées de sa destruction (monocytes, macrophages, polynucléaires). Dans tous les cas ces cellules absorbent le pathogène par endocytose, et le détruisent au niveau de leurs lysosomes.
Endocytose
C'est justement le processus d'internalisation d'une molécule (ou d'une cellule) par une autre cellule, et sa dégradation par les hydrolases lysosomiques de cette dernière. Par exemple, l'endocytose des glycoprotéines sanguines est un phénomène observé dans les cellules hépatiques, qui possèdent une lectine de surface très affine pour les glycanes tri- ou tétrantennés ayant du galactose à leurs extrémités non réductrices. Les autres glycanes ne sont pratiquement pas reconnus. La capture des glycoprotéines par les lectines est suivie de la formation d'un endosome (vésicule d'endocytose) qui conduit les protéines jusqu'aux lysosomes où elles sont dégradées. La plupart des glycoprotéines circulantes ont leurs glycanes substitués par de l'acide sialique et ne sont pas reconnues par les lectines hépatiques. L'enlèvement de l'acide sialique par une neuraminidase plasmatique démasque le β-galactose, et la glycoprotéine (asialoglycoprotéine) est retirée du plasma sanguin en quelques minutes.
D'autres cellules reconnaissent les structures oligomannosidiques. Les cellules nerveuses, en particulier, captent les glycanes où le mannose est phosphorylé en C6.Les hydrolases lysosomiques sont elles-même ciblées vers le lysosome par le mannose 6-phosphate, grâce à des lectines. Les défauts génétiques dans ces systèmes de ciblage sont responsables de maladies de surcharge, où les lysosomes s'engorgent de produits non dégradés.
Inflammation
La migration des leucocytes dans l'organisme est contrôlée, du moins en partie, par des glycanes. Au cours de la réaction inflammatoire, les cellules endothéliales des vaisseaux sanguins placent à leur surface une lectine qui reconnaît et lie les glycanes de surface des leucocytes circulants. Ceux-ci adhèrent localement à la paroi vasculaire, puis ils la traversent (extravasation) et infiltrent les tissus sous-jacents.
Cancerisation et métastases
On note de profondes modifications de la structure des glycanes de surface des cellules cancéreuses. Ces modifications incluent l'hypersialylation (exagération du taux de substitution par l'acide sialique), qui explique la forte électronégativité de surface de ces cellules, et la substitution par des chaînes de 20 à 50 unités de N-acétyllactosamine. Ces modifications s'accompagnent de la perte de l'inhibition de contact et des propriétés d'aggrégation des cellules normales. Les cellules prolifèrent et se détachent de la tumeur initiale. La formation des métastases en d'autres points de l'organisme pourrait mettre en jeu des mécanismes proches de ceux de l'inflammation. Les glycanes modifiés des cellules cancéreuses seraient reconnus par les cellules de l'endothélium vasculaire, conduisant à l'extravasation et à l'invasion des tissus sous-jacents par les cellules, avec formation de foyers métastatiques.