Domaines de prédominance des espèces - représentation par rapport au potentiel standard
Comme pour les équilibres acidobasiques pour lesquels la prédominance des espèces en fonction du \(\textrm{pH}\) dépendait de la valeur des \(\textrm pK_a\), on peut définir pour les couples rédox des domaines de prédominance en fonction de la valeur du potentiel d'équilibre de la solution.
La prédominance des espèces est alors fonction de la valeur des potentiels standard des couples par la relation de Nernst.
Pour les équilibres acides-bases, on a
\(\textrm{pH} = \textrm pK_a + \log \frac{[\textrm B]}{[\textrm A]}\)
d'où le diagramme de prédominance de A et B en fonction du \(\textrm{pH}\) :
si \(\textrm{pH} >> \textrm pK_a\textrm{ , }[\textrm B]\gg[\textrm A]\) :
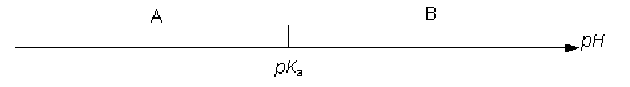
Pour un équilibre rédox \(\textrm{Ox} + n.\textrm e^- \textrm{ }^\to_\gets\textrm{ Red}\) (par exemple le couple \(\textrm{Fe}^{3+} / \textrm{Fe}^{2+}\)), on a
\(E=E°-\frac{\textrm{0,06}}{n}\log\frac{a_{\textrm{Red}}}{a_{\textrm{Ox}}}\)
d'où le diagramme de prédominance des espèces \(\textrm{Ox}\) et \(\textrm{Red}\) en fonction du potentiel d'équilibre de la solution \(E\) :
si \(E\gg E°\), \(a_{\textrm{Ox}}\gg a_\textrm{Red}\)
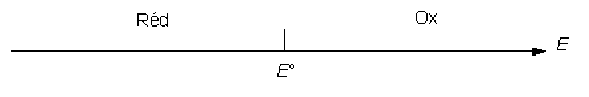
Avec le couple \(\textrm{Fe}^{3+} / \textrm{Fe}^{2+}\), on aurait par exemple
\(E = E°- \textrm{0,06}. \log \frac{[\textrm{Fe}^{2+}]}{[\textrm{Fe}^{3+}]}\)
Si les concentrations de \(\textrm{Fe}^{2+}\textrm{ et }\textrm{Fe}^{3+}\) sont égales, on a bien sur \(E = E° = \textrm{0,77 V}\) .Supposons maintenant qu'une des 2 espèces ait une concentration 1000 fois plus élevée que l'autre, la valeur de \(E\) va varier d'une valeur \(\Delta E\) égale en plus ou en moins à
\(\Delta E =\textrm{0,06}.\log 1000\) soit \(\Delta E =\textrm{0,18 V}\) :
le potentiel d'électrode reste du même ordre de grandeur que le potentiel standard \(E°\) même pour des valeurs relativement différentes des concentrations (activités) des espèces.
Dans ces conditions, les espèces \(\textrm{Fe}^{3+}\) et \(\textrm{Fe}^{2+}\) sont tout à fait représentatives du fer aux nombres d'oxydation +3 et +2. On peut dire alors que le couple rédox est représentatif du couple rédox général \(\textrm{Fe (III) / Fe (II)}\).
L'écriture de la loi de Nernst
\(E = E° - \frac{\textrm{0,06}}{n} \log \frac{a_\textrm{Red}}{a_\textrm{Ox}}\)
est très simplifiée car contrairement aux équilibres acido-basiques, les réactions rédox ont rarement des stoechiométries simples. Dans un premier temps le diagramme précédent donnera malgré tout une information qualitative fort utile lorsqu'on envisage des réactions d'oxydoréduction entre 2 couples rédox.