Les groupes fonctionnels
L'une des performances exceptionnelles de la RMN du \(\textrm{}^{13}\textrm C\) est l'accès direct à l'information concernant les carbones fonctionnels.
Le carbonyle \(\textrm{>C=O}\) est un excellent exemple, mais n'est pas le seul observable. Dans son cas, il s'ajoute au statut de carbone \(\textrm{sp}^2\) (fort déplacement chimique) la polarisation de la double liaison \(\textrm{C=O}\), ce qui va déplacer le signal du \(\textrm C\) des carbonyles entre 150 et 220 ppm
Remarque :
Notez que le remplacement de l'oxygène par des atomes plus lourds, tel que le soufre donne des déblindage plus importants encore...
Le carbone du \(\mathrm{\succ C=S}\) résonne en effet vers 270 ppm.
Cette zone du spectre presque exclusive des fonctions carbonées peut être considérée comme une empreinte fonctionnelle !
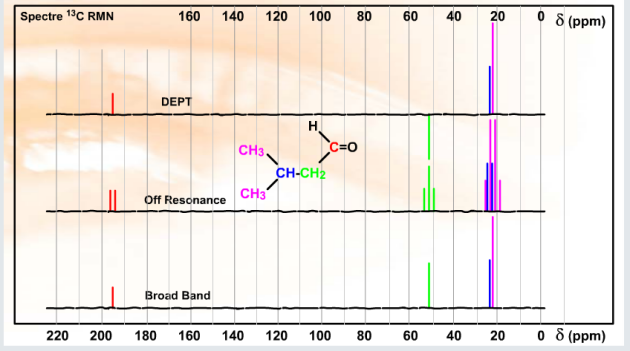
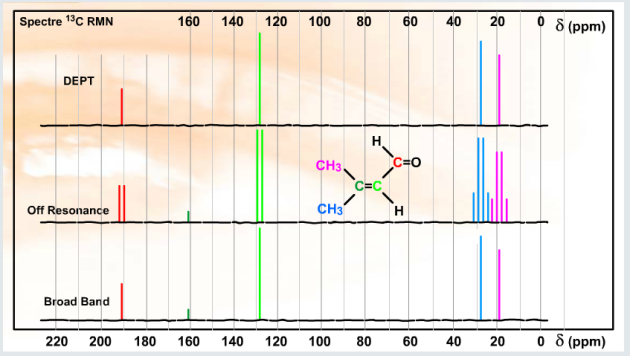
Pour les cétones et les aldéhydes, rien ne vient altérer la polarisation forte de la liaison à l'origine du fort déblindage du carbone et le domaine d'observation est compris entre 190 et 220 ppm. A savoir aussi, la conjugaison de la fonction peut entraîner des blindages d'une dizaine de ppm, regardez les exemples ci-dessous.
Les aldéhydes sont de plus très aisément identifiable car ils sont (avec les dérivés de l'acide formique \(\textrm{HCOOH}\)) les seuls signaux des carbones de carbonyles présentant un couplage \(\textrm{}^1\textrm J\) entre le \(\textrm{}^{13}\textrm C\) et le \(\textrm{}^1\textrm H\). Le signal du \(\textrm{CHO}\) apparaît donc sous forme de doublet dans le spectre Off Resonance.
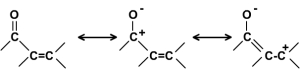
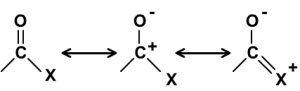
Le blindage lié à la conjugaison mérite d'être expliqué dans la mesure où les mêmes raisons expliquent le blindage relatif des carbonyles plus complexes à savoir des acides et de leurs dérivés. Les raisons du fort déblindage du \(\mathrm{>C=O}\) repose sur la polarisation de la liaison que traduit la forme canonique chargée suivante :
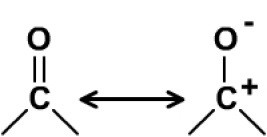
avec \(\textrm X\) = \(\textrm{-OH}\), \(\textrm{-OR}\), \(\textrm{-NH}_2\),\(\textrm{ -NHR}\), \(\textrm{-NR}_2\), ....
Ainsi, les déplacements ne cessent de décroître avec l'augmentation du pouvoir donneur de \(\textrm X\). Pour les composés de type \(\textrm{CH}_3\textrm{COX}\) on observe les déplacements chimiques suivants :
X | \(\mathrm{-CH_3}\) | \(\mathrm{-H}\) | \(\mathrm{-CH=CH_2}\) | \(\mathrm{-SH}\) | \(\mathrm{-OH}\) | \(\mathrm{-OCH_3}\) | \(\mathrm{-NH_2}\) | \(\mathrm{-Cl}\) | \(\mathrm{-Br}\) | \(\mathrm{-I}\) |
\(\delta\) | 206,7 | 200,5 | 197,5 | 194,5 | 176,9 | 171,3 | 173,4 | 170,4 | 165,7 | 158,9 |
Vous trouverez dans les tables générales des déplacements chimiques l'illustration de ces variations.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.