Conformations des oses cyclisés
La représentation conformationnelle de Reeves rend compte de la structure tridimensionnelle d'un ose.
La formule plane de Haworth suffit à l'écriture des formules des oses dans certaines situations, comme par exemple la description d'une réaction. Elle devient insuffisante dès qu'il s'agit de décrire les molécules dans l'espace. La représentation conformationnelle de Reeves comble cette lacune.
La représentation conformationnelle de Reeves est calquée sur la structure tridimensionnelle de la molécule observée dans une position très précise. Elle s'applique aussi bien aux furanoses qu'aux pyranoses :
Complément :
Le cycle du D-ribofuranose est placé dans un plan globalement horizontal. Le carbone 1 se trouve sur la droite de l'observateur, qui voit l'oxygène du cycle à l'arrière du modèle. Les figurations des atomes sont effacées pour ne garder que le squelette covalent, qui est lui-même schématisé tel qu'il est observé. Il s'agit ici d'une conformation dite "enveloppe".
Le cycle furanose n'est pas plan, il est plissé. Seuls trois ou quatre atomes sont coplanaires. Lorsqu'un seul atome est hors du plan formé par les autres, on parle de conformation enveloppe ou E (comme dans la figure ci-dessus, la forme du cycle rappelle une enveloppe ouverte avec son rabat). Quand deux atomes sont exclus du plan, ils sont en général chacun d'un côté du cycle et on parle de conformation twist ou T.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Complément :
Le cycle du D-glucopyranose est placé dans un plan globalement horizontal. Le carbone 1 se trouve sur la droite de l'observateur, qui voit l'oxygène du cycle à l'arrière droit du modèle. Les figurations des atomes sont effacées pour ne garder que le squelette covalent, qui est lui-même schématisé tel qu'il est observé. Il s'agit ici d'une conformation "chaise".
Le cycle pyranose est également plissé et montre la conformation chaise caractéristique des cycles saturés à six atomes comme le cyclohexane. La représentation conformationnelle met en évidence deux types de positions pour les substituants du cycle. Toute liaison perpendiculaire au plan moyen du cycle est dite axiale, et toute liaison approximativement parallèle au plan moyen du cycle est dite équatoriale. Un avantage structural apporté par la conformation chaise d'un pyranose est que tous les substituants des carbones y sont décalés. D'autres conformations, comme le bateau, peuvent également exister mais elles sont en général trop instables pour pouvoir être observées, car elles placent tous les substituants du cycle en position éclipsée.
Complément : Observer
Observer les positions des substituants dans les formes chaise et bateau
Cette observation nécessite de connaître le principe de représentation de Newman...
La configuration relative d'un ose dicte sa conformation cyclique.
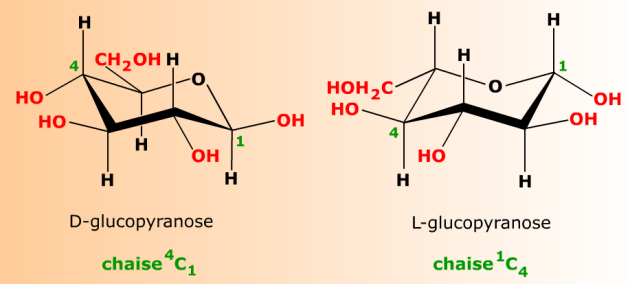
En application du principe de positionnement équatorial des gros substituants, il est logique d'attendre une influence de la configuration relative sur la conformation d'un cycle. Ceci est particulièrement évident dans le cas des hexoses énantiomères, où deux formes chaise inversées l'une par rapport à l'autre sont observables.
Complément :
Les conformations chaises du D- et du L-glucopyranose sont inversées l'une par rapport à l'autre, de manière à placer, dans chaque cas, les gros substituants (en rouge) en position équatoriale. Les positions relatives de C1 et de C4 par rapport au plan du cycle servent d'indicateurs de la conformation.
La forme chaise 4C1 (plus souvent appelée C1) est la conformation la plus probable du D-glucopyranose. La forme chaise 1C4 (plus souvent appelée 1C) est celle du L-glucopyranose. L'exposant devant le C identifie le carbone situé au dessus du plan moyen du cycle dans la représentation de Reeves, et l'indice qui suit le C identifie le carbone situé au dessous.
Pour un ose donné, le passage d'une conformation chaise à l'autre s'appelle inversion du cycle et n'implique que des rotations des carbones autour de leurs liaisons. Les deux formes chaises sont donc des rotamères. L'inversion du cycle est un phénomène rare à température ambiante, compte tenu de la barrière énergétique qui sépare les deux formes. Il s'accentue avec le chauffage des solutions, sous l'effet de l'agitation thermique.