Règles de cyclisation des oses
La forme cyclique majoritaire d'un ose en solution résulte de trois règles.
Il n'y a que deux formes cycliques essentiellement utilisées par les oses : furanoses et pyranoses. D'autres formes cycliques sont possibles, mais sont extrèmement minoritaires ( voir Principaux cycles des oses).
Les pyranoses sont plus stables, donc plus souvent représentés, que les furanoses, car ils permettent un meilleur décalage des gros substituants du cycle sur deux carbones consécutifs (voir Conformations des oses cyclisés). Dans la mesure du possible (voir ci-dessous), tout ose tend donc à adopter la forme pyranose.
Un alcool secondaire plus réactif est généralement plus utilisé qu'un alcool primaire au moment de la cyclisation. Il peut cependant arriver que l'avantage structural apporté par la forme pyranose compense la difficulté à former un hémiacétal sur un alcool primaire.
L'application de ces trois règles permet de prédire la cyclisation des oses.
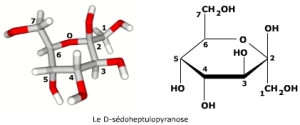
Les aldohexoses (comme le D-glucose) et les cétoheptoses (comme le D-sédoheptulose) cyclisent majoritairement sous forme pyranose (99% pour le D-glucose et environ 70% pour le D-galactose), en utilisant l'alcool secondaire du carbone 5 (aldohexoses) ou 6 (cétoheptoses). La forme linéaire ouverte concerne moins de 0,1% des molécules.
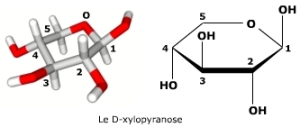
Les aldopentoses (comme le D-ribose) et les cétohexoses (comme le D-fructose) cyclisent à plus de 60% (65% pour le ribose et 75% pour le fructose à 25°C) sous forme pyranose en utilisant l'alcool primaire du carbone 5 (pentoses) ou 6 (cétohexoses). L'avantage structural apporté par le pyranose compense la moindre réactivité de l'alcool primaire dans la fermeture du cycle. Le pourcentage restant est formé de cycles furanoses mettant en jeu un alcool secondaire (25% pour le fructose à 25°C). Une exception qui confirme la règle est celle du D-xylose (illustré ci-dessous) qui se présente presque exclusivement sous forme pyranose. Les formes linéaires ouvertes sont en général négligeables à l'équilibre.
Les cétopentoses (comme le D-ribulose) et les tétroses ne se cyclisent pratiquement pas (les formes cyclisées existent mais sont extrèmement minoritaires en solution). En effet, avec 4 carbones et un oxygène, ces molécules ne peuvent former que des furanoses, en utilisant l'alcool primaire du carbone 5 (cétopentoses) ou 4 (tétroses). Les conditions de la cyclisation sont donc doublement défavorables.