Oxydation des oses
Par les oxydants doux
Complément :
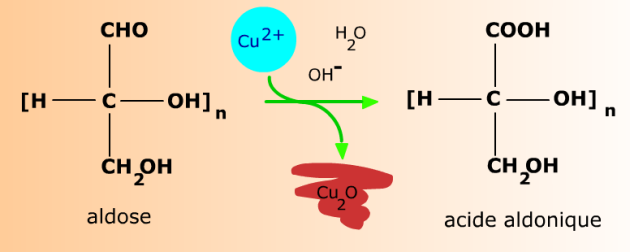
Réaction d'oxydation des aldoses par la liqueur de Fehling : à chaud en milieu alcalin, l'oxyde cuivrique (bleu) est réduit en oxyde cuivreux (rouge brique) insoluble, tandis que l'aldose s'oxyde en acide aldonique.
Le nom d'un acide aldonique s'obtient en remplaçant le suffixe -ose par -onate ou -onique dans le nom de l'aldose d'origine. Par exemple, le glucose donne l'acide gluconique (ou gluconate), le mannose, l'acide mannonique (ou mannonate), etc...
Les acides aldoniques sont produits à grande échelle par l'oxydation des aldoses par le brome. Lorsqu'on fait ensuite évaporer le solvant, les acides aldoniques se condensent en γ-lactones (une lactone est un ester cyclique formé par condensation de l'acide carboxylique et d'une fonction alcool). La lettre grecque désigne le carbone porteur de l'oxygène du cycle, dans la nomenclature des acides carboxyliques.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Complément :
Les lactones se forment lors de l'évaporation de solutions contenant des acides aldoniques.
La détection des aldoses par leur pouvoir réducteur n'est pas spécifique.
Dans l'histoire de la physiologie et de la médecine, de nombreux tests ont été utilisés pour détecter le glucose dans les urines, par son pouvoir réducteur (test de glycosurie).
La liqueur de Fehling a été l'un des réactifs les plus utilisés. Il s'agit d'une solution alcaline (dite cupro-sodique) d'oxyde de cuivre CuO. Les ions Cu2+ n'étant pas solubles en milieu alcalin, on leur associe du tartrate de sodium. L'ion tartrate forme un complexe soluble avec le Cu(II) et maintient ce dernier en solution. La liqueur de Fehling prête à l'emploi est donc une solution translucide de couleur bleue caractéristique de l'oxyde cuivrique. A chaud et en présence d'un ose réducteur, le Cu(II) se réduit en Cu(I) qui ne forme plus de complexe avec le tartrate. Un précipité rouge brique de Cu2O insoluble se forme dans ces conditions. D'autres tests ont été pratiqués sur le même principe. Le test de Benedict utilise le citrate au lieu du tartrate dans la préparation de la liqueur cupro-sodique. Le test de Tollens utilise du nitrate d'argent ammoniacal dont la réduction donne un précipité d'argent métallique qui se dépose sur les parois du tube à essais (test du miroir).
Ces divers tests permettent la détection d'un pouvoir réducteur, mais ne permettent pas de doser précisément les molécules responsables. La méthode de dosage dite de Somogyi-Nelson comble cette lacune. Cette méthode reprend le principe du test à la liqueur de Fehling, mais dans un second temps le Cu2O précipité est lui-même réoxydé en CuO soluble par l'arséno-molybdate (en jaune) qui se réduit à son tour en un composé coloré vert-bleu. La solution finale, redevenue translucide, peut être étudiée par colorimétrie à 520 nm. La concentration d'oses dans la solution initiale se déduit de la comparaison des mesures de densité optique avec une gamme-étalon, constituée de solutions d'oses de concentrations connues.
Quoiqu'il en soit, dans les conditions de ces tests, à chaud et en milieu alcalin, les cétoses s'isomérisent en aldoses (voir Isomérisation). Ces tests ne sont donc pas spécifiques du glucose ni des aldoses en général, mais des oses totaux (en l'absence, bien sûr, de toute autre molécule porteuse de fonction aldéhyde...).
L'oxydation enzymatique du glucose par la glucose-oxydase est un test très spécifique.
Le test du glycostat, actuellement utilisé en médecine pour les mesures de glycémie, repose sur l'oxydation enzymatique très spécifique du glucose en acide gluconique par la glucose-oxydase. La réaction utilise le dioxygène dissous dans le milieu comme agent oxydant, et produit de l'eau oxygénée (peroxyde d'hydrogène H2O2) qui oxyde à son tour un produit incolore (chromogène) en un produit coloré dosable par colorimétrie.
Le sensibilité de ce test permet de l'adapter à des systèmes portables et utilisables à domicile par les patients. Les réactifs sont conditionnés sur des bandelettes de papier sur lesquelles il suffit de déposer une goutte de sang pour déclencher la réaction. Un colorimètre de poche dans lequel on insère la bandelette mesure par réflexion la quantité de colorant formé, et calcule la concentration de glucose.
LIEN VERS OBSERVER LE GLUCOSTAT ! ! ! ! ! ! !
Complément : Observer
Observer le glucostat
Cette image montre l'un des systèmes commerciaux de mesure de la glycémie.
Par les oxydants forts
Les oxydants forts oxydent les aldoses en acides aldariques...
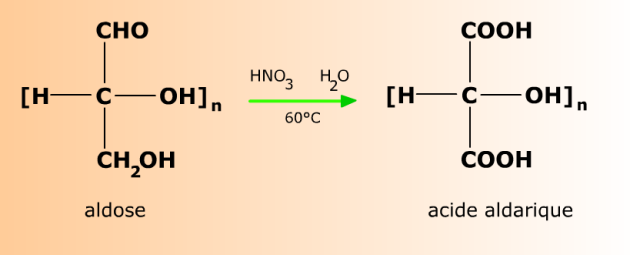
L'oxydation vigoureuse d'un aldose (par l'acide nitrique dilué à chaud par exemple) conduit à l'attaque simultanée de l'alcool primaire terminal et de l'aldéhyde. On obtient un di-acide carboxylique appelé acide aldarique.
Le nom d'un acide aldarique s'obtient en remplaçant le suffixe -ose par -arate ou -arique dans le nom de l'aldose d'origine. Par exemple, le glucose donne l'acide glucarique (ou glucarate, également nommé acide saccharique ), le galactose l'acide galactarique (ou galactarate), etc...
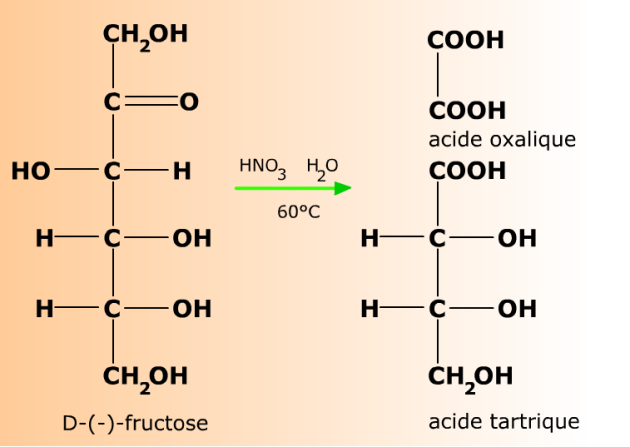
...et rompent le squelette carboné des cétoses.
La même réaction d'oxydation provoque la coupure oxydante du squelette carboné des cétoses.