Ethers et esters
Du fait des nombreuses fonctions alcool présentes, les oses peuvent être convertis en divers dérivés d'alcools, éthers et esters.
Les principaux éthers d'oses sont des éthers O-méthyliques.
Il existe quelques éthers naturels d'oses : le 2-O-méthyl-L-fucose et le 6-O-méthyl D-galactose s'isolent à partir des algues et des plantes. Au laboratoire, la méthylation des oses se fait avec l'iodure de méthyle ICH3 et de l'oxyde d'argent, ou bien avec du sulfate de diméthyle (CH3)2SO4 en mileu alcalin (NaOH).
Complément :
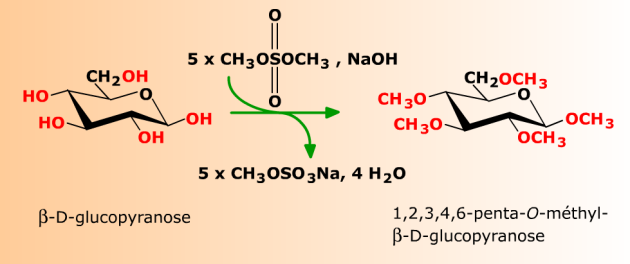
En milieu alcalin (NaOH), le glucopyranose est converti en penta-O-méthyl-D-glucopyranose par le sulfate de diméthyle.
On appelle perméthylation la réaction prolongée conduisant à la méthylation de tous les hydroxyles accessibles d'un ose. Parmi ceux-ci se trouve l'hydroxyle hémiacétalique dont les propriétés diffèrent de celles des hydroxyles d'alcools. Sa méthylation conduit à la formation réversible d'un acétal (voir Additions réversibles). Contrairement aux éthers, les acétals sont sensibles à l'hydrolyse acide.
Complément :
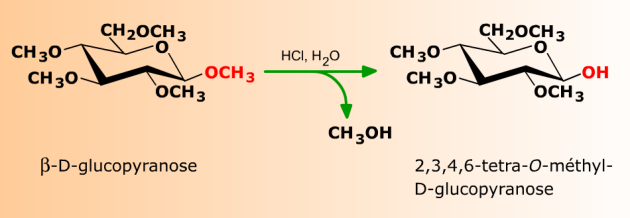
L'hydrolyse acide d'un ose perméthylé libère sélectivement l'hydroxyle hémiacétalique.
La perméthylation des oses est une technique très largement utilisée dans la détermination de structure des oligo- et polysaccharides (voir Analyse structurale des oligosaccharides). En bloquant les fonctions alcool, elle rend les oses plus hydrophobes et plus volatils, donc plus faciles à séparer par différentes méthodes chromatographiques, dont la chromatographie en phase gazeuse, et plus faciles à analyser, en spectrométrie de masse par exemple.
Les oses forment des esters avec les anhydrides et les chlorures d'acides.
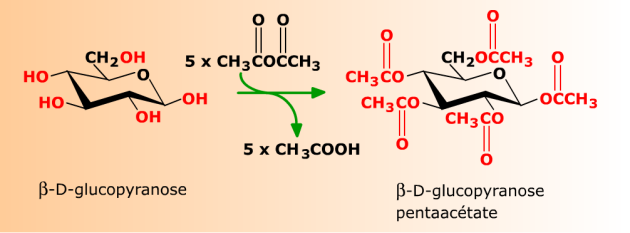
En milieu pyridine, l'anhydride acétique CH3-CO-O-CO-CH3 réagit avec le glucopyranose en formant du glucose-pentaacétate et de l'acide acétique CH3COOH. La formation d'esters étant réversible par hydrolyse, elle est souvent utilisée pour protéger les groupes réactionnels des sucres dans d'autres réactions.
Complément :
En milieu pyridine, à 0°C pendant 24h, le glucopyranose est converti en son dérivé penta-acétylé en présence d'un excès d'anhydride acétique.
Des esters d'oses existent à l'état naturel. Des oses mono- et diphosphate (voir Oses phosphorylés) sont essentiels dans le métabolisme énergétique. Des oses sulfatés entrent dans la composition des glycosaminoglycanes (voir Glycosaminoglycanes).