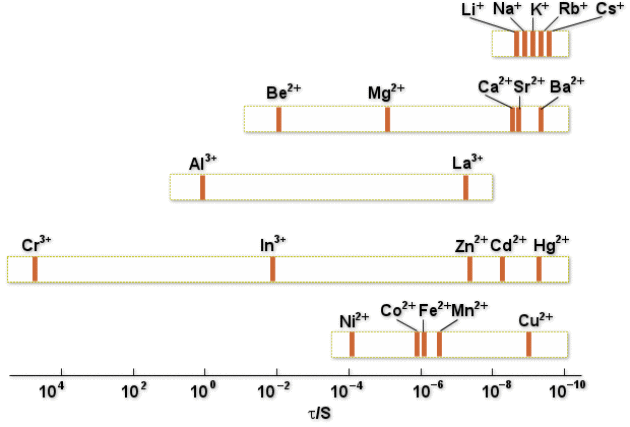
Influence du cation métallique
On considère la réaction d'échange d'eau marquée[1] :
\(\textrm M(\textrm H_2\textrm O)_\textrm y^{\textrm z+} + \textrm H_2\textrm{}^{17}\textrm O \to \textrm M(\textrm H_2\textrm O)_{\textrm y-1} (\textrm H_2\textrm{}^{17}\textrm O)^{\textrm z+} + \textrm H_2\textrm O\)
Cette réaction peut être suivie par différentes techniques expérimentales, en particulier par la R.M.N. de l'oxygène 17.
Soit \(\textrm k\) la constante de vitesse de la réaction.
Si la réaction est du premier ordre, \(\textrm k\) s'exprime en s-1.
Le temps de demi-réaction est \(\tau =\frac{\ln 2}{\textrm k}\).
Si \(\tau\) est grand la cinétique est lente ; si \(\tau\) est faible, la cinétique est rapide.
Les métaux sont divisés en quatre classes (figure ci-après) :
Classe I : échange très rapide (\(\tau\approx10^{-8}\textrm{ s}\))
complexes liés par des forces électrostatiques,
charges faibles, rayons importants,
\(\frac{Z^2}{\textrm r} < 10^{28}\textrm{ C}^2\textrm m^{-1}\) (\(\textrm Z\) charge du métal, \(\textrm r\) rayon du métal),
alcalins, gros alcalino-terreux.
Classe II : échange rapide (\(\tau \approx 10^{-5} - 10^{-8}\textrm{ s}\))
Métaux de transition \(\textrm M^{2+}\) avec de faibles ESCC,
Lanthanides \(\textrm L^{3+}\),
\(10^{28}\textrm{ C}^2\textrm m^{-1} < \frac{Z^2}{r} < 30.10^{28}\textrm{ C}^2\textrm m^{-1}\) (\(Z\) charge du métal,\( r\) rayon du métal).
Classe III : échange assez lent (\(\tau \approx 10^{-4} -1\textrm{ s}\))
Métaux de transition \(\textrm M^{3+}\) et ions très petits (\(\textrm{Be}^{2+}\) et \(\textrm{Al}^{+3}\)),
\(\frac{\textrm Z^2}{\textrm r} > 30.10^{28}\textrm{ C}^2\textrm m^{-1}\) (\(Z\) charge du métal, \(r\) rayon du métal).
Classe IV : échange très lent (\(\tau > 1\textrm{ s}\))
\(\textrm{Cr}^{3+}\), \(\textrm{Ru}^{3+}\), \(\textrm{Pt}^{2+}\), \(\textrm{Ru}^{2+}\),
Très fortes ESCC.