Utilisation du diagramme
Écrivons la « Loi d'Action de Masse » à l'équilibre entre métal, oxygène, et oxyde, par exemple :
\(2x.\textrm{M (s)} + \textrm O_2 \textrm{(g)}\leftrightarrow 2.\textrm M_x\textrm{O (s)}\textrm{ }\textrm{ }\Delta_\textrm rG^{\circ}_T=-RT\ln K_p\)
\(K_p=\textrm e\Big(-\frac{\Delta\textrm fG^{\circ}_T}{RT}\Big)=a(\textrm M_x\textrm O)^2/ a(\textrm O_2) \cdot a(\textrm M)^{2x}\)
Les activités de l'élément \(\textrm M\) et de l'oxyde \(\textrm M_x\textrm O\) sont égales à 1 car ce sont un corps pur et un composé pur, tous deux à l'état condensé. Celle du dioxygène gazeux peut être assimilée à sa pression partielle.
\(\Delta_\textrm rG^{\circ}_T=-RT\ln\Big(\frac{1}{p_{\textrm O_{2, \textrm{eq}}}}\Big)\)
\(\Delta_\textrm rG^{\circ}_T=RT\ln(p_{\textrm O_{2, \textrm{eq}}})\)
\(\Rightarrow\ln(p_{\textrm O_{2, \textrm{eq}}})=\Big(\frac{\Delta_\textrm rH^{\circ}}{R}\Big)\Big(\frac{1}{T}\Big)-\Big(\frac{\Delta_\textrm rS^{\circ}}{R}\Big)\)
On peut donc réinterpréter l'axe des ordonnées comme étant le logarithme de la pression d'oxygène (multiplié par \(RT\)). C'est donc un potentiel d'oxydation. La droite d'Ellingham d'équation \(RT\ln(p_{\textrm O_{2, \textrm{eq}}})=f(T)\) coupe le plan en deux régions : le domaine d'existence du métal, situé en dessous, et le domaine d'existence de l'oxyde, situé au-dessus.
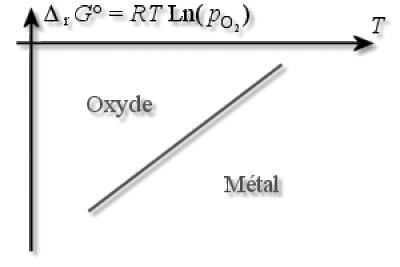
Si \(p_{\textrm O_2}>p_{\textrm O_{2, \textrm{eq}}}\), on est dans le domaine de stabilité de l'oxyde.
Si \(p_{\textrm O_2}>p_{\textrm O_{2, \textrm{eq}}}\), on est dans le domaine de stabilité du métal.
La courbe d'Ellingham représente donc le lieu des températures où une espèce \(\textrm{Red}\) est en équilibre avec sa forme oxydée \(\textrm{Ox}\). Dans un diagramme d'Ellingham, l'espèce oxydante d'un couple \(\textrm{Ox / Red}\) est stable au-dessus de la droite d'équilibre, d'où l'attribution des domaines de prédominance.
Exemple : Un oxyde à un seul degré d'oxydation : MgO
\(\Delta_\textrm fH^{\circ}(\textrm{MgO})=-602 \textrm{kJ.mol}^{-1}\)
\(\Delta_\textrm fS^{\circ}(\textrm{MgO})=-108 \textrm{J.mol}^{-1}\textrm{.K}^{-1}\)
La pression de dioxygène à l'équilibre est \(p_{\textrm O_{2, \textrm{eq}}}\approx10^{-51} \textrm{atm}\) à 1000 K, donc une pression d'oxygène très faible peut déjà conduire à l'oxydation de \(\textrm{Mg}\) à 1000 K. En effet, \(\textrm{Mg}\) est très réducteur, et \(\textrm{MgO}\) est très stable.