Synthèse de la magnétite Fe3O4 sous mélange de gaz CO-CO2
Partie
Question
Le but de cet exercice est de déterminer les conditions de synthèse de la magnétite \(\textrm{Fe}_3\textrm O_4\) à partir d'un autre oxyde de fer à \(927 °\textrm C\). A une température donnée, la composition d'un oxyde est définie par sa pression partielle d'oxygène d'équilibre.
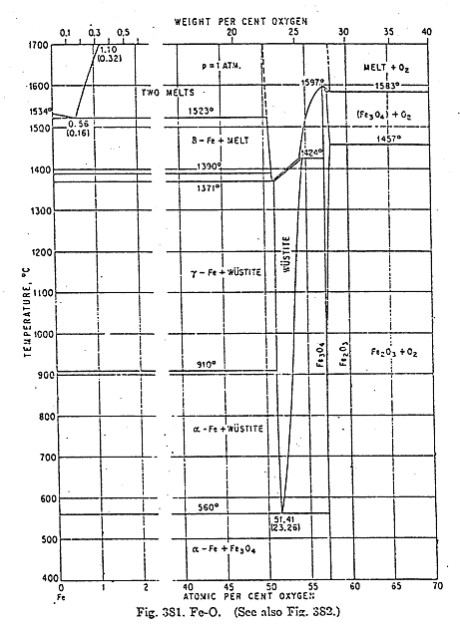
Le diagramme de phase du système \(\textrm{Fe}-\textrm O\) est donné figure 1 ci-dessous. Donner le nom des trois oxydes que l'on peut obtenir ainsi que leurs domaines d'existence en température. Préciser si ce sont des composés définis ou s'ils présentent un domaine d'existence.
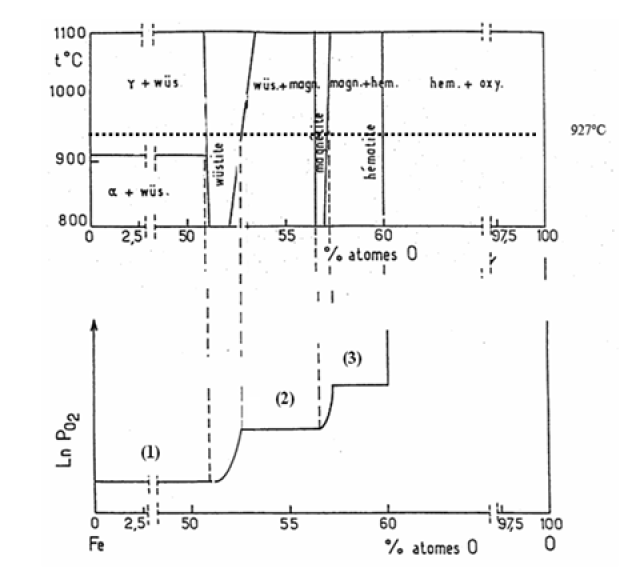
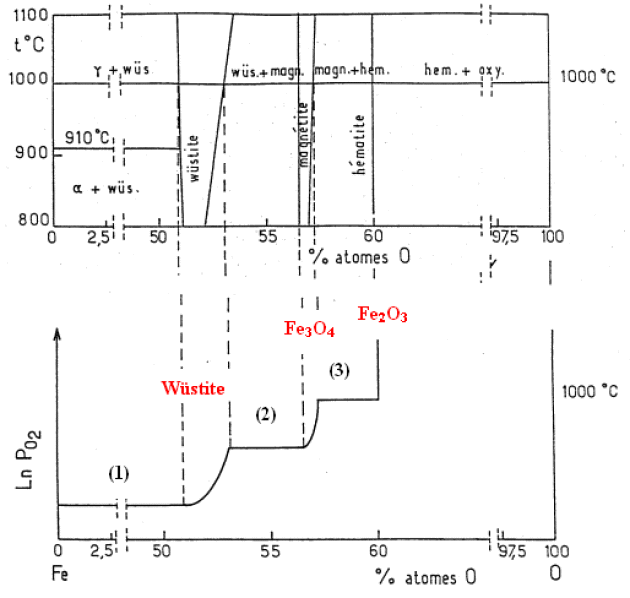
On considère maintenant le diagramme isobare pression partielle d'oxygène - composition du système \(\textrm{Fe}-\textrm O\) à \(927 °\textrm C\) (figure 2 ci-dessous). Identifier les domaines d'existence du fer, de la wüstite, de la magnétite et de l'hématite. Ecrire les équilibres réactionnels correspondants aux différents plateaux observés.
A partir des enthalpies libres standards de formation des oxydes \(\Delta_\textrm fG°\) à \(927 °\textrm C\), reportées dans le tableau 1 ci-dessous, calculer les pressions partielles de dioxygène pour chacun des équilibres précédents. Quelle est la pression d'oxygène nécessaire pour obtenir la phase \(\textrm{Fe}_3\textrm O_4\) à partir de la wüstite ?
On cherche à obtenir cette pression partielle de dioxygène par un mélange gazeux de \(\textrm{CO}\) et de \(\textrm{CO}_2\), sachant que l'on a l'équilibre suivant :
\(\textrm{CO (g)}+\frac{1}{2}.\textrm O_2\textrm{ (g)}\leftrightarrow\textrm{CO}_2\textrm{ (g)}\) (a)
Quel rapport \(\frac{p_\textrm{CO}}{p_{\textrm{CO}_2}}\) préconisez-vous pour réaliser la synthèse de la question précédente ?
On réalise la synthèse de la magnétite à \(927 °\textrm C\) à partir de la wüstite sous mélange gazeux \(\textrm{CO}-\textrm{CO}_2\) adapté. Le produit est alors refroidi jusqu'à température ambiante. Calculez la pression partielle d'oxygène d'équilibre pour la réaction de synthèse de \(\textrm{Fe}_3\textrm O_4\) à \(627 °\textrm C\). Vérifier que les valeurs des \(p\textrm{O}_2\) imposées par la réaction (a) conduisent à la formation de magnétite pour \( 927 °\textrm C\) et \(627 °\textrm C\). Que peut-on dire pour le refroidissement ?
Sachant qu'il existe l'équilibre de Boudouard :
\(\textrm{CO}_2\textrm{ (g)}+\textrm{C (s)}\leftrightarrow2.\textrm{CO (g)}\) (b)
Calculer l'activité du carbone solide à \(927 °\textrm C\) et \(627 °\textrm C\).
Que pensez-vous d'un refroidissement lent ?
\(\mathrm{FeO}\) | \(\mathrm{Fe_3O_4}\) | \(\mathrm{Fe_2O_3}\) | \(\mathrm{CO}\) | \(\mathrm{CO_2}\) | |
\(\Delta_fG°(KJ/mol)\) à 927°C | -186,34 | -731,90 | -512,22 | -217,56 | -395,76 |
\(\Delta_fG°(KJ/mol)\) à 627°C | -205,66 | -822,04 | -615,54 | -191,20 | -395,41 |
Solution détaillée
1.
La wüstite existe de \(T=560 °\textrm C\) à \(T=1424 °\textrm C\). \(\textrm{FeO}_{1+x}\) possède un domaine d'existence en fuseau.
La magnétite \(\textrm{Fe}_3\textrm O_4\) est un composé défini de \(400 °\textrm C\) à environ \(1000 °\textrm C\), et présente un domaine d'existence de \(1000 °\textrm C\) à \(1597 °\textrm C\).
L'hématite \(\textrm{Fe}_2\textrm O_3\) est un composé défini de \(400 °\textrm C\) à \(1457 °\textrm C\).
2. domaines d'existence :
(1)\( 2.\textrm{Fe}+\textrm O_2\leftrightarrow 2.\textrm{FeO}\textrm{ }\textrm{ }\textrm{ }\Delta G°\textrm{(1)}=2.\Delta_\textrm fG°\textrm{(FeO)}-2.\Delta_\textrm fG°\textrm{(Fe)}-\Delta_\textrm fG°\textrm{(O}_2\textrm)\)
(2) \(6.\textrm{FeO}+\textrm O_2\leftrightarrow 2.\textrm{Fe}_3\textrm O_4\textrm{ }\textrm{ }\textrm{ }\Delta G°\textrm{(2)}=2.\Delta_\textrm fG°\textrm{(Fe}_3\textrm O_4\textrm)-6.\Delta_\textrm fG°\textrm{(FeO)}\)
(3) \(4.\textrm{Fe}_3\textrm O_4+\textrm O_2\leftrightarrow6.\textrm{Fe}_2\textrm O_3 \textrm{ }\textrm{ }\textrm{ }\Delta G^{\circ}\textrm{(3)}=6.\Delta_\textrm fG°\textrm{(Fe}_2\textrm O_3\textrm)-4.\Delta_\textrm fG°\textrm{(Fe}_3\textrm O_4\textrm)\)
3. Pressions d'oxygène d'équilibre :
A l'équilibre, l'enthalpie libre de la réaction est nulle soit : \(\Delta G=0\).
On en déduit : \(\Delta\textrm G=\Delta\textrm G°+\textrm{RT}\ln\textrm K=0\) avec \(K=\substack{\textrm i}{\Pi}\frac{a_{\textrm{produit}}}{a_{\textrm{réactifs}}}\).
D'où : \(\Delta G°=-RT\ln K\).
Si on considère les activités des solides égales à un, la constante d'équilibre \(K\) est égale à :
\(K=\frac{1}{p_{\textrm{O}_{2, \textrm{\'eq}}}}\)
On peut alors déduire la relation suivante :
\((p_{\textrm{O}_2})_{\textrm{eq},\textrm i}=\exp(\frac{\Delta G^{\circ}\textrm{(i)}}{RT})\)
D'où :
\(\Delta G°\textrm{(1)}=-372\textrm,68\textrm{ kJ.mol}^{-1}\textrm{ }\textrm{ }\textrm{ }(p\textrm{O}_2)_{\textrm{éq},1}=6\textrm,15.10^{-17}\textrm{ atm}\)
\(\Delta G°\textrm{(2)}=-345\textrm,76\textrm{ kJ.mol}^{-1}\textrm{ }\textrm{ }\textrm{ }(p\textrm{O}_2)_{\textrm{éq},2}=9\textrm,11.10^{-16}\textrm{ atm}\)
\(\Delta G^{\circ}\textrm{(3)}=-145\textrm,72\textrm{ kJ.mol}^{-1}\textrm{ }\textrm{ }\textrm{ }(p\textrm{O}_2)_{\textrm{éq}3}=4\textrm,58.10^{-7}\textrm{ atm}\)
La pression à laquelle wüstite et magnétite sont en équilibre à \(927 °\textrm C\) est \(9\textrm,11.10^{-16}\textrm{ atm}\). Donc, en partant de la wüstite que l'on oxyde, la pression d'oxygène nécessaire pour obtenir la magnétite pure à \(927 °\textrm C\) doit être légèrement supérieure à \(9\textrm,11.10^{-16}\textrm{ atm}\), pour que toute la wüstite soit transformée en \(\textrm{Fe}_3\textrm O_4\).
4. mélange \(\textrm{CO}-\textrm{CO}_2\) :
La constante \(K'\) de l'équilibre \(\textrm{CO}+\frac{1}{2}.\textrm O_2\leftrightarrow \textrm{CO}_2\) est égale à :
\(K'=\frac{[p\textrm{CO}]^2[p\textrm{O}_2\textrm]}{[p\textrm{CO}_2\textrm]^2}\)
L'enthalpie de la réaction est égale à :
\(\Delta G°'=2\Delta_\textrm fG°\textrm{(CO}_2\textrm)-2\Delta_\textrm fG°\textrm{(CO)}=356\textrm,40\textrm{ kJ.mol}^{-1}\)
On a donc
\(\Delta G°'=-RT\ln(\frac{[p\textrm{CO}]^2[p\textrm{O}_2\textrm]}{[p\textrm{CO}_2\textrm]^2})\)
Soit
\(\frac{p\textrm{CO}}{p\textrm{CO}_2}=\exp(\frac{1}{2}\times(\frac{\Delta G°'}{RT}-\ln p\textrm{O}_2))\)
Pour la réaction (2), on obtient une valeur du rapport de 0,58. La valeur de \(p\textrm{O}_2\) nécessaire étant légèrement supérieure, on préconise une valeur du rapport \(p\textrm{CO}/p\textrm{CO}_2\) légèrement inférieure à 0,58 soit par exemple 0,5 (en effet un rapport \(p\textrm{CO}/p\textrm{CO}_2\) qui diminue, c'est une pression d'oxygène équivalente qui augmente).
Pour un rapport de \(p\textrm{CO}/p\textrm{CO}_2=0\textrm,5\), on obtient une pression partielle d'oxygène de \(1\textrm,25.10^{-15}\textrm{ atm}\) à l'équilibre (\(>9\textrm,11.10^{-16}\textrm{ atm}\)).
5. Calcul de la pression partielle d'oxygène \((p\textrm{O}_2)_{\textrm{éq}}\) à \(627 °\textrm C\) :
Pour la réaction (2) : \(\Delta G°\textrm{(2)}=2\Delta_\textrm fG°\textrm{(Fe}_3\textrm O_4\textrm)-6\Delta_\textrm fG°\textrm{(FeO)}=-410\textrm,12\textrm{ kJ.mol}^{-1}\)
soit \((p\textrm{O}_2)_{\textrm{éq, 2}}=1\textrm,63.10^{-24}\textrm{ atm}\).
Pour la réaction (a) : \(\Delta G°\textrm{(a)}=2\Delta_\textrm fG°\textrm{(CO}_2\textrm)-2\Delta_\textrm fG°\textrm{(CO)}=-408\textrm,42\textrm{ kJ.mol}^{-1}\)
soit \((p\textrm{O}_2)_{\textrm{éq,a}}=2\textrm,05.10^{-24}\textrm{ atm}\).
La pression partielle d'oxygène obtenue à l'aide du mélange \(\textrm{CO}-\textrm{CO}_2\) est proche de celle nécessaire pour l'équilibre mais légèrement supérieure. On aura donc la phase \(\textrm{Fe}_3\textrm O_4\) pure. Les conditions thermodynamiques sont favorables pour le refroidissement si seul l'équilibre (a) intervient entre \(\textrm{CO}\) et \(\textrm{CO}_2\).
6. Calcul de l'activité du carbone :
Cherchons tout d'abord les valeurs de \(p\textrm{CO}\) et \(p\textrm{CO}_2\).
Sachant que \(p\textrm{CO}+p\textrm{CO}_2+p\textrm{O}_2={p}°=1\textrm{ atm}\), et que \(p\textrm{O}_2\approx10^{-15}\textrm{ atm}\), on peut négliger la pression partielle d'oxygène dans cette équation et en déduire que \(p\textrm{CO}+p\textrm{CO}_2\approx1\textrm{ atm}\). Si le rapport \(p\textrm{CO}/p\textrm{CO}_2=0\textrm,5\), on peut calculer :
\(p\textrm{CO}=0\textrm,33\textrm{ atm}\) et \(p\textrm{CO}_2=0\textrm,66\textrm{ atm}\)
\(\Delta G°\textrm{(b)}=2\Delta_\textrm fG°\textrm{(CO)}-\Delta_\textrm fG°\textrm{(CO}_2\textrm)-\Delta_\textrm fG°\textrm{(C)}\)
pour \(T=927 °\textrm C\), l'enthalpie libre est \(\Delta G°\textrm{(b)}=-39\textrm,36\textrm{ kJ.mol}^{-1}\)
pour \(T=627 °\textrm C\), l'enthalpie libre est \(\Delta G°\textrm{(b)}=13\textrm,01\textrm{ kJ.mol}^{-1}\)
La constant \(K"\) de l'équilibre de Boudouard est :
\(K"=\frac{(p\textrm{CO})^2}{p\textrm{CO}_2\times a_\textrm C}=\exp(\frac{\Delta G°\textrm{(b)}}{RT})\)
On peut donc calculer \(a_\textrm C\) l'activité du carbone à \(927 °\textrm C\) et \(627 °\textrm C\).
\(a_\textrm C=(\frac{(p\textrm{CO})^2}{p\textrm{CO}_2})\times \exp(\frac{\Delta G°\textrm{(b)}}{RT})\)
On obtient alors les résultats suivants :
à \(927 °\textrm C\), \(a_\textrm C=3\textrm,20.10^{-3}\)
à \(627 °\textrm C\), \(a_\textrm C=0\textrm,937\)
Ce calcul montre que lorsque la température diminue, l'activité du carbone augmente. Lorsque \(a_\textrm C\) tend vers 1, le carbone se forme sous forme de phase séparée, car il est en trop grande quantité pour rester dissous dans la magnétite. C'est ce que l'on cherche à éviter si on veut une phase \(\textrm{Fe}_3\textrm O_4\) pure. Si on réalise une trempe (refroidissement rapide), on bloque la cinétique de formation du carbone à basse température. Dans ce cas, on peut obtenir la magnétite pure.