Pile à combustible
Partie
Question
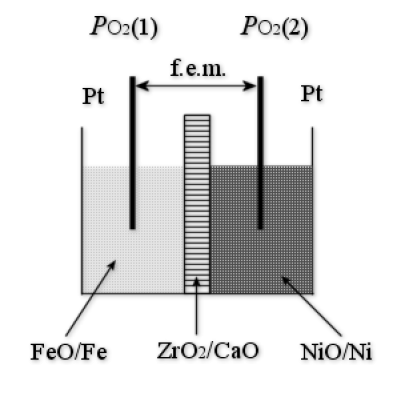
Une solution solide de composition \(\textrm{ZrO}_2 85\)% - \(\textrm{CaO} 15\)% est utilisée comme membrane conductrice ionique entre \(1100 \textrm K\) et \(1400 \textrm K\). Elle a une structure de type fluorine \(\textrm{CaF}_2\) dans laquelle la présence de \(\textrm{CaO}\) crée une importante concentration en lacunes d'ions oxydes. De part et d'autre du conducteur ionique, on dispose deux électrodes :
l'électrode (1) est constituée de \(\textrm O_2\textrm{ (g) FeO/Fe}\),
l'électrode (2) est constituée de \(\textrm O_2\textrm{ (g) NiO/Ni}\).
Les métaux et les oxydes sont mélangés sous forme de poudre. Tous les constituants sont considérés comme pur dans leur phase, et leur activité sera donc prise égale à l'unité. Chaque couple « métal/oxyde » est en équilibre sous sa pression d'oxygène ( \(P_{\textrm O_2}(1)\) ou \(P_{\textrm O_2}(2)\)). Les mesures de potentiel sont assurées par des fils de platine plongés dans les mélanges solides.
Écrire les équations des réactions d'électrode et celle de la pile, sachant que le fer s'oxyde lorsque la pile débite.
Établir une relation donnant la f.e.m. en fonction des pressions partielles de dioxygène \(P_{\textrm O_2}(1)\) et \(P_{\textrm O_2}(2)\) , qui sont les pressions partielles de dioxygène en équilibre avec les électrodes (1) et (2), à l'équilibre et à la température \(T\). A quel(s) type(s) de pile s'apparente ce type de dispositif ?
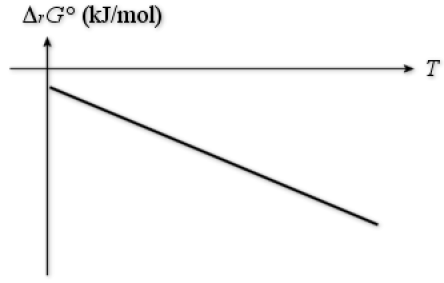
La force électromotrice est mesurée pour quelques températures. Tracer la courbe \(\Delta_\textrm rG°=f(T).\Delta_\textrm rG°\) étant la variation d'enthalpie libre standard de la réaction de la pile. En déduire \(\Delta_\textrm rH°\) et \(\Delta_\textrm rS°\).
Donnée : Constante de Faraday \(\textrm F = 96500 \textrm{ C.mol}^{−1}\).
T(K) | 1150 | 1200 | 1250 | 1300 | 1350 |
E(mV) | 246 | 251 | 256 | 261 | 266 |
Solution détaillée
1. La membrane est conductrice par les anions \(\textrm O^{2-}\), d'où :
\(\textrm{Fe}+\textrm O^{2-}\to\textrm{FeO}+2.\textrm e^-\textrm{ }\textrm{ }\Delta_\textrm rG°\textrm{(1)}=2.FE_1\)
\(\textrm{NiO}+2.\textrm e^-\to\textrm{Ni}+\textrm O^{2-}\textrm{ }\textrm{ }\Delta_\textrm rG°\textrm{(2)}=-2.FE_2\)
soit : \(\textrm{Fe}+\textrm{NiO}\to\textrm{FeO}+\textrm{Ni}\textrm{ }\textrm{ }\Delta_\textrm rG°=-2.F(E_2-E_1)\)
2. L'enthalpie libre de la réaction globale \(\Delta_\textrm rG°\) correspond donc à la différence :
\(\Delta_\textrm rG°=\Delta_\textrm fG°\textrm{(FeO)}-\Delta_\textrm fG°\textrm{(NiO)}\)
Les grandeurs de formation correspondent aux équilibres suivants, effectivement réalisés dans le système étudié :
\(\textrm{Fe}+\frac{1}{2}.\textrm O_2\leftrightarrow\textrm{FeO}\textrm{ }\textrm{ }\Delta_\textrm fG°\textrm{(FeO)}=-RT\ln(\frac{P°}{P_{\textrm O2}})^{\frac{1}{2}}=\frac{RT}{2}\ln(\frac{P_{\textrm O2}\textrm{(1)}}{P°})\)
\(\textrm{Ni}+\frac{1}{2}.\textrm O_2\leftrightarrow\textrm{NiO}\textrm{ }\textrm{ }\Delta_\textrm fG°\textrm{(NiO)}=-RT\ln(\frac{P°}{P_{\textrm O2}})^{\frac{1}{2}}=\frac{RT}{2}\ln(\frac{P_{\textrm O2}\textrm{(2)}}{P°})\)
D'où : \(\Delta_\textrm rG°=-2FE°=\frac{RT}{2}\ln\Big(\frac{P_{\textrm O_2}\textrm{(1)}}{P_{\textrm O_2}\textrm{(2)}}\Big)\)
Ce système s'apparente à une pile à combustible, car si l'on maintient les deux moitiés à la même pression d'oxygène, on aura combustion du Fer par \(\textrm O_2\) puisque le système tendra à rétablir une pression d'oxygène au-dessus du fer plus basse :
\(\textrm{Fe}+\frac{1}{2} \textrm O_2\textrm{ (g)}\to\textrm{FeO}\)
Ce système s'apparente également à une pile de concentration. En effet, les réactifs sont des gaz et l'existence de la f.e.m. tient à la non-égalité des pressions partielles.
3. On sait que l'enthalpie libre et le potentiel de la pile sont reliés par la relation :
\(\Delta_\textrm rG°=-2FE°\)
On peut donc en déduire le tableau suivant :
T(K) | 1150 | 1200 | 1250 | 1300 | 1350 |
\(\Delta_rG°(\mathrm{kJ/mol)}\) | -47,47 | -48,42 | -49,40 | -50,36 | -51,33 |
Une régression linéaire ou une construction graphique confirme l'existence d'une droite dont l'ordonnée à l'origine est \(-25\textrm,25\textrm{ kJ.mol}^{-1}\) et la pente \(-19\textrm,32.10^{-3}\textrm{ kJ.mol}^{-1}.\textrm K^{-1}\)
Or :
\(\Delta_\textrm rG°=\Delta_\textrm rH°-T\Delta_\textrm rS°\)
Donc si on considère que \(\Delta_\textrm rH°\) et \(\Delta_\textrm rS°\), on obtient :
\(\Delta_\textrm rH°=-25\textrm,25\textrm{ kJ.mol}^{-1}\)
\(\Delta_\textrm rS°=19\textrm,32\textrm{ J.K}^{-1}\textrm{mol}^{-1}\)