Enthalpie libre de formation des oxydes. Diagrammes d'Ellingham
Partie
Question
1. Soit la réaction :
\(\textrm{Zn}+\frac{1}{2}.\textrm O_2\leftrightarrow\textrm{ZnO}\) (1)
Calculer \(\Delta H°_1\) et \(\Delta S°_1\) pour cette réaction à \(298 \textrm K\) et \(600 \textrm K\). En déduire que l'on peut appliquer l'hypothèse d'Ellingham pour cette réaction.
2. En faisant l'hypothèse d'Ellingham, établir les diverses relations \(\Delta G°_1(T)\) pour la réaction (1) sur l'intervalle \(298 \textrm K-2000 \textrm K\). Attention aux changements d'état !
3. Calculer de même \(\Delta G°_2(T)\), \(\Delta G°_3(T)\) et \(\Delta G°_4(T)\) pour les réactions :
\(\frac{1}{2}.\textrm C+\frac{1}{2}.\textrm O_2\to\frac{1}{2}.\textrm{CO}_2\) (2)
\(\textrm C+\frac{1}{2}.\textrm O_2\to\textrm{CO}\) (3)
\(\textrm{CO}+\frac{1}{2}.\textrm O_2\to\textrm{CO}_2\) (4)
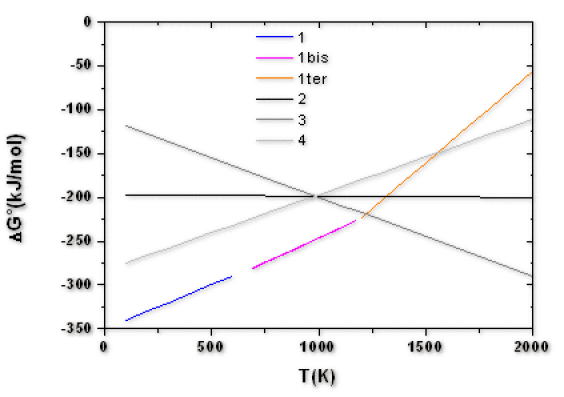
Tracer sur un même graphe \(\Delta G°_1(T)\) , \(\Delta G°_2(T)\), \(\Delta G°_3(T)\) et \(\Delta G°_4(T)\)
4. Au delà de certaines températures, l'oxyde de \(\textrm{Zn}\) peut réagir soit avec \(\textrm C\), soit avec \(\textrm{CO}\).
Ecrire les équilibres chimiques des réactions.
Déterminer graphiquement et par le calcul les températures minimales pour lesquelles ces réaction peuvent avoir lieu.
Quelle est la réaction qui est thermodynamiquement favorisée ? Calculer sa constante d'équilibre à \(1500 \textrm K\).
5. On place, dans une enceinte de 10 litres, un mélange équimolaire de carbone et d'oxyde de zinc qu'on porte à \(1500 \textrm K\). Quelle doit être la masse minimale de carbone introduite pour que le système soit en équilibre, tous les gaz étant supposés parfaits
Données :
\(T_{\textrm{fusion}}\textrm{(Zn)}=420 °\textrm C\) , \(T_{\textrm{fusion}}\textrm{(ZnO)}=1925 °\textrm C\), \(T_{\textrm{ébulition}}\textrm{(Zn)}=907 °\textrm C\)
\(M\textrm{(C)}=12\textrm{ g.mol}^{-1}\)
\(\Delta H^{\circ}_{\textrm{fusion}}\textrm{(Zn)}=-6\textrm,7\textrm{ kJ.mol}^{-1}\), \(\Delta H°_{\textrm{ébulition}}\textrm{(Zn)}=114\textrm,8\textrm{ kJ.mol}^{-1}\)
\(\Delta H°(\mathrm{kJ.mol^{-1}})\) à 298 K | \(\Delta S°(\mathrm{J.mol^{-1}.K^{-1}})\) à 298 K | \(C_p(\mathrm{J.mol^{-1}.K^{-1}})\) | |
\(\mathrm{Zn}\) | 0 | 42 | 25,4 |
\(\mathrm{ZnO}\) | -350,5 | 43,6 | 40,3 |
\(\mathrm{O_2}\) | 0 | 205 | 29,4 |
\(\mathrm{C}\) | 0 | 5,7 | 8,5 |
\(\mathrm{CO_2}\) | -393,5 | 214 | 37 |
\(\mathrm{CO}\) | -110 | 198 | 29 |
Solution détaillée
1. On a :
\(\Delta H°_1\textrm{(298)}=\Delta H°_\textrm f\textrm{(ZnO)}=-350\textrm,5\textrm{ kJ.mol}^{-1}\)
\(\Delta S°_1\textrm{(298)}=S°_{298}\textrm{(ZnO)}-S°_\textrm{298}\textrm{(Zn)}-\frac{1}{2}.S°_{298}\textrm{(O}_2\textrm)=-100\textrm,9\textrm{ J.K}^{-1}.\textrm{mol}^{-1}\)
En écrivant que : \(\Delta H°_1\textrm{(600)}=\Delta H°\textrm{(298)}+\in t^{600}_{298}\Delta C_p\frac{\textrm{d}T}{T}\), on obtient : \(\Delta H°_1\textrm{(600)}=-350\textrm,44\textrm{ kJ.mol}^{-1}\).
De même, on a \(\Delta S°_1\textrm{(600)}=\Delta S°_1\textrm{(298)}+\in t^{600}_{298}\Delta C_p\frac{\textrm{d}T}{T}\).
D'où \(\Delta S°_1\textrm{(600)}=-100\textrm,76\textrm{ J.K}^{-1}\textrm{.mol}^{-1}\)
On constate que \(\Delta H°_1\) et \(\Delta S°_1\) sont pratiquement indépendants de la température. L'hypothèse d'Ellingham est donc applicable.
2.
De \(298 \textrm K\) à \(693 \textrm K\) (température de fusion du zinc), \(\textrm{Zn}\) est solide d'où :
\(\Delta G°_1=-350500-100\textrm,9\times T\) en J/mol
De \(693 \textrm K\) à \(1180 \textrm K\), le \(\textrm{Zn}\) est liquide. La réaction étudiée est :
\(\textrm{Zn (l)}+\frac{1}{2}.\textrm O_2\to\textrm{ZnO (s)}\) , avec :
\(\Delta H°_{1\textrm{bis}}\textrm{(298)}=\Delta H°_1\textrm{(298)}-\Delta H°_{\textrm{fus}}\textrm{(Zn)}=-357200\textrm{ J.mol}^{-1}\)
\(\Delta S°_{1\textrm{bis}}\textrm{(298)}=\Delta S°_1\textrm{(298)}-\frac{\Delta H°_{\textrm{fus}}\textrm{(Zn)}}{T_{\textrm{fusion}}}=-110\textrm,6\textrm{ J.K}^{-1}.\textrm{mol}^{-1}\)
On en déduit : \(\Delta S^{\circ}_{1\textrm{bis}}=-357200+110\textrm,6\times T\).
De \(1180 \textrm K\) à \(2000 \textrm K\), le zinc est à l'état de vapeur. On aura de même :
\(\Delta G°_{1\textrm{ter}}=-472000+207\textrm,9\times T\)
Remarquons que \(\textrm{ZnO}\) est toujours solide dans l'intervalle de température étudié.
3. Avec les valeurs numériques fournies dans le tableau, on calcule de même, en J/mol :
\(\Delta G°_2=-196750-1\textrm,65\times T\)
\(\Delta G°_3=-110000-89\textrm,8\times T\)
\(\Delta G°_4=-283500+86\textrm,5\times T\)
4.
a Les réactions possibles sont :
\(\textrm{ZnO}+\textrm{CO}\to\textrm{Zn}+\textrm{CO}_2\) (5)
\(\textrm{ZnO}+\frac{1}{2}.\textrm C\to\textrm{Zn}+\frac{1}{2}.\textrm{CO}_2\) (6)
\(\textrm{ZnO}+\textrm C\to\textrm{Zn}+\textrm{CO}\) (7)
b Ces réactions seront possibles lorsque : \(\Delta G°_\textrm i-\Delta G°_1<0\), soit pour des températures supérieures aux températures suivantes :
\(T_5=1553 \textrm K\)
\(T_6=1314 \textrm K\)
\(T_7=1216 \textrm K\)
c La réaction la plus favorable thermodynamiquement à \(1500 \textrm K\) sera celle pour laquelle \(\Delta G°_i-\Delta G°_1\) aura la valeur la plus faible : c'est-à-dire la réaction (7).
\(\textrm{ZnO}+\textrm C\to\textrm{Zn (g)}+\textrm{CO (g)}\)
avec \(\Delta G°_7=362000-297\textrm,7\times T\)
soit à \(1500 \textrm K\) : \(\Delta G°_7=-84550\textrm{ J.mol}^{-1}\)
A l'équilibre on sait que \(\Delta G°=-RT\ln K°\), d'où l'on calcule \(K°=875\textrm,5\).
5. La constante d'équilibre \(K°\) est égale à \(K°=P_{\textrm{CO}}\times P_{\textrm{Zn}}=(P_{\textrm{CO}})^2=(P_{\textrm{Zn}})^2\), où les pressions sont normalisées par rapport à 1 bar.
A l'équilibre \(P_{\textrm{CO}}=P_{\textrm{Zn}}\), car on a le même nombre de moles de \(\textrm{Zn}\) et de \(\textrm{CO}\) produites.
Donc \(P_{\textrm{CO}}=P_{\textrm{Zn}}={(K^{\circ})}^{\frac{1}{2}}=29\textrm,6\textrm{ bar}\).
Le nombre de moles de \(\textrm{CO}\) est donc \(n_\textrm{CO}=\frac{P_{\textrm{CO}}V}{RT}=2\textrm,41\textrm{ mole}\).
Il faut donc que l'on ait mis au minimum 2,41 moles de carbone, soit une masse de carbone de : \(m_\textrm C=n_\textrm C\times M_\textrm C=28\textrm,9 \textrm g\).